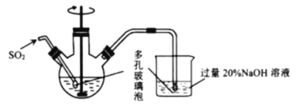
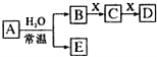
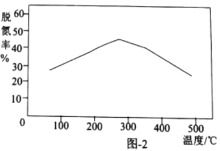
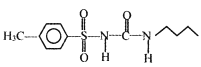
题目内容
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
【答案】B
【解析】
A.根据电池反应:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3可知:金属锌失电子,发生氧化反应,作负极,A错误;
B.金属锌作负极,失电子,发生氧化反应;MnO2作正极,得电子,发生还原反应,电子从负极Zn流向正极MnO2,B正确;
C.MnO2得电子发生还原反应,C错误;
D.由Zn+2MnO2+H2O=Zn(OH)2+Mn2O3可知:1 mol Zn反应失去2 mol电子,则转移0.1 mol电子,需要Zn的物质的量是n(Zn)=![]() ×0.1 mol=0.05 mol,其质量m(Zn)=0.05 mol×65 g/mol=3.25 g,D错误;
×0.1 mol=0.05 mol,其质量m(Zn)=0.05 mol×65 g/mol=3.25 g,D错误;
故合理选项是B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目