题目内容
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液在如下图所示的装置中 进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
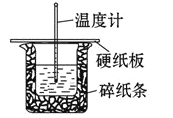
(1)从实验装置上看,图中缺少的一种玻璃仪器是_____。
(2)烧杯间填满碎纸条的作用是_____。
(3)若大烧杯上不盖硬纸板,求得的反应热数值______填“偏大”“偏小”或“无影响”)。
(4)若取取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液的密度都是 1 g/cm3,中和后生成溶液 的比热容 c=4.18 J/(g·℃)。则中和热△H=_____(取小数点后一位)。
【答案】环形玻璃搅拌棒减少实验过程中的热量损失偏小-53.5 kJ/mol
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)不盖硬纸板,会有一部分热量散失;
(4)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m·c·△T计算反应放出的热量,然后根据△H=-Q/nkJ·mol-1计算出反应热.
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,偏小;
(4)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组舍去,温度差平均值=(4.0℃+3.9℃+4.1℃)/3=4.0℃;②50mL0.50mol·L-1氢氧化钠与30mL0.50mol·L-1硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol·L-1=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m·c·△T=80g×4.18J/(g·℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-1.3376kJ/0.025mol=-53.5kJ·mol-1.

 精英口算卡系列答案
精英口算卡系列答案【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D