题目内容
2.(Ⅰ)某盐由原子序数处于前20的三种元素组成,相对式量为98,其焰色反应为紫色(透过蓝色的钴玻璃).向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀.(1)三种元素中原子序数最小的简单离子的离子结构示意图
 ,
,(2)该盐的化学式为KAlO2,
(3)白色沉淀在水中电离的方程式AlO2-+H++H2O?Al(OH)3?Al3++3OH-.
(Ⅱ) 某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C.在一定条件下可以用H3PO2与CuSO4溶液混合制备A,A可以在氯气中燃烧.
(1)A的化学式为CuH
(2)H3PO2与CuSO4溶液混合制备A中氧化产物为H3PO4
(3)写出A在氯气中燃烧的方程式2CuH+3Cl2=2CuCl2+2HCl
(4)有人认为还有一种组成元素与A相同的二元化合物,此物质的化学式为CuH2,若此物质为离子化合物,则电子式为[H:]-Cu2+[H:]-.
(5)A与盐酸能反应的原因CuH中氢为-1价,可以和盐酸中+1的氢离子发生归中反应.
分析 (Ⅰ)焰色反应为紫色(透过蓝色的钴玻璃),说明含有K元素,向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀,说明为偏铝酸盐,相对式量为98,应为KAlO2;
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,在一定条件下可以用H3PO2与CuSO4溶液混合制备A,说明B为Cu,
且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C.A可以在氯气中燃烧,可知C为H2,A为CuH.
解答 解:(Ⅰ)焰色反应为紫色(透过蓝色的钴玻璃),说明含有K元素,向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀,说明为偏铝酸盐,相对式量为98,应为KAlO2,
(1)三种元素中原子序数最小的简单离子为O2-,离子结构示意图 ,故答案为:
,故答案为: ;
;
(2)由以上分析可知该盐为KAlO2,故答案为:KAlO2;
(3)白色沉淀为Al(OH)3,为两性氢氧化物,电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-,故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,在一定条件下可以用H3PO2与CuSO4溶液混合制备A,说明B为Cu,
且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C.A可以在氯气中燃烧,可知C为H2,A为CuH,
(1)由以上分析可知A为CuH,故答案为:CuH;
(2)H3PO2与CuSO4溶液混合,Cu被还原,则H3PO2被氧化,氧化产物为H3PO4,故答案为:H3PO4;
(3)CuH在氯气中燃烧生成氯化氢和氯化铜,方程式为2CuH+3Cl2=2CuCl2+2HCl,
故答案为:2CuH+3Cl2=2CuCl2+2HCl;
(4)组成元素与A相同的二元化合物为CuH2,电子式为[H:]- Cu2+[H:]-,故答案为:CuH2;[H:]- Cu2+[H:]-;
(5)CuH中氢为-1价,可以和盐酸中+1的氢离子发生归中反应而生成氢气,故答案为:CuH中氢为-1价,可以和盐酸中+1的氢离子发生归中反应.
点评 本题考查无机物推断,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,需要学生熟练掌握元素化合物知识,难度不大.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 己烷、己烯、己炔 | B. | 苯、己烯、乙醇 | C. | 溴苯、乙醇和甲苯 | D. | 硝基苯、苯和甲苯 |
| A. | 在加热条件下,浓硫酸和浓硝酸均能与木炭反应 | |
| B. | 将浓硫酸和浓硝酸分别长期露置于空气中,浓度均会升高 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铝反应,所以常温下二者都不能用铝制容器盛放 |

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如下装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
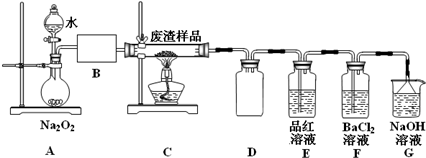
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).
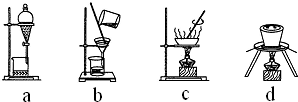
步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.
 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )| A. | 该电池工作时的总反应式为4NH3+5O2═4NO+6H2O | |
| B. | 电池工作时,接触面上的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 固体氧化物作为电池工作时的电解质,其作用是让电子在电池内部移动 | |
| D. | 外电路的电流方向为从电极a流向电极b |
| A. | 氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| B. | 玻璃钢是钢与玻璃纤维形成的复合材料 | |
| C. | 石油化工废弃物易造成水体富营养化 | |
| D. | 硫酸铵是常用的一种硝态氮肥 |
| 实验操作 | 现象 | 结论 | |
| A | 淀粉溶液中加入碘水 | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察 | 沉淀的生成 | 检验是否含SO42- |
| D | 向某未知溶液中加入NaOH浓溶液,加热,在试管口用湿润的蓝色石蕊试纸检验 | 试纸变红 | 检验是否含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图: