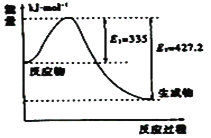
题目内容
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
【答案】B
【解析】
①M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗,则N电极上铜离子得电子生成Cu,为原电池正极,所以金属活动性M>N;
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极,电子流出的电极是负极、电子流入的电极是正极,所以金属活动性P>Q;
中,Q是电子流入的一极,电子流出的电极是负极、电子流入的电极是正极,所以金属活动性P>Q;
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡,P电极上氢离子得电子发生还原反应生成氢气,则P是正极,金属活动性M>P;
,P极产生大量气泡,P电极上氢离子得电子发生还原反应生成氢气,则P是正极,金属活动性M>P;
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应,则Q为负极、N为正极,金属活动性Q>N;
中,Q极发生氧化反应,则Q为负极、N为正极,金属活动性Q>N;
通过以上分析知,金属活动性强弱顺序是M>P>Q>N,故选B。

练习册系列答案
相关题目
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D