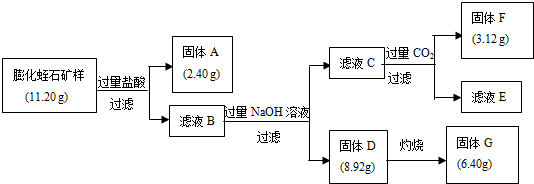
题目内容
1.海水中镁离子Mg2+总量可观,但是浓度并不高.从海水中提取镁的主要工艺是:①海水与废碱溶液(含大量OH-)作用,生成氢氧化镁沉淀;
②分离出沉淀;
③沉淀与盐酸反应,得到高浓度的氯化镁溶液.写出主要反应的离子方程式:
①Mg2++2OH-=Mg(OH)2↓
③Mg(OH)2+2H+=Mg2++2H2O
第②步的操作名称为A(填序号).
A.过滤 B.蒸馏 C.萃取 D.分液.
分析 分析过程可知,海水中加入废碱溶液生成氢氧化镁沉淀,生成的氢氧化镁沉淀与盐酸反应生成氯化镁和水,分离沉淀的方法为过滤.
解答 解:海水中加入废碱溶液生成氢氧化镁沉淀,生成的氢氧化镁沉淀与盐酸反应生成氯化镁和水,
①海水与废碱溶液(含大量OH-)作用,生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓;
②分离出沉淀;
③沉淀与盐酸反应,得到高浓度的氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
第②步的操作分离出氢氧化镁沉淀,实验操作的名称为过滤,
故答案为:Mg2++2OH-=Mg(OH)2↓;Mg(OH)2+2H+=Mg2++2H2O;A.
点评 本题考查了海水中镁的提取过程,溶液中得到固体的条件应用,反应过程中沉淀溶解于生成的反应离子方程式书写,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列有关化学用语错误的是( )
| A. | N原子价层轨道表示式: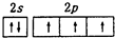 | |
| B. | H2O电子式为 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)原子的原子结构示意图为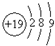 |
11.下列化学用语表达错误的是( )
| A. | 甲烷的结构式: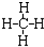 | B. | 丙烯的结构简式CH3CHCH2 | ||
| C. | 葡萄糖分子式:C6H12O6 | D. | 甲烷分子球棍模型: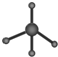 |
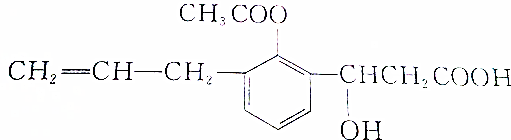
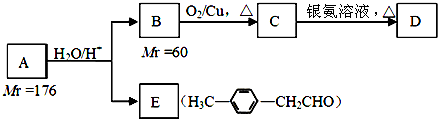
 .
.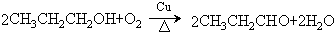 .
.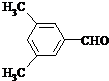 、
、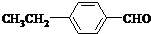 .
. )的合成路线流程图如下:
)的合成路线流程图如下: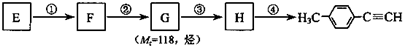
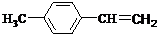 ,③的反应类型为加成反应.
,③的反应类型为加成反应.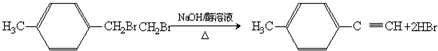 .
.