题目内容
1.①Cl2比S容易与H2化合;②Cl2能从Na2S溶液中置换出S;
③HClO3酸性比H2SO3的酸性强;
④与Fe反应时Cl2能生成高价铁化合物,S只能生成低价铁化合物;
⑤Cl2熔沸点比S的低.
能说明Cl比S的非金属性强是( )
| A. | 只有④ | B. | ①②④ | C. | ①②③④ | D. | ①②③④⑤ |
分析 非金属的非金属性越强,其最高价氧化物的水化物酸性越强、其氢化物的稳定性越强、与氢气越容易化合、单质的氧化性越强,据此分析解答.
解答 解:①Cl2比S容易与H2化合,说明氯气的氧化性大于S,则非金属性Cl>S,故正确;
②Cl2能从Na2S溶液中置换出S,说明氯气的氧化性大于S,则非金属性Cl>S,故正确;
③HClO3酸性比H2SO3的酸性强,因为这两种酸不是它们的最高价含氧酸,所以不能据此判断非金属性强弱,故错误;
④与Fe反应时Cl2能生成高价铁化合物,S只能生成低价铁化合物,说明氯气的氧化性大于S,则非金属性Cl>S,故正确;
⑤Cl2熔沸点比S的低,与非金属性强弱无关,与分子间作用力有关,故错误;
故选B.
点评 本题考查元素周期律的综合利用,侧重考查学生分析判断能力,非金属性强弱与其最高价氧化物的水化物酸性、氢化物的稳定性、单质的氧化性等有关,与单质的熔沸点、溶解性等无关,题目难度不大.

练习册系列答案
相关题目
12.下列各组混合物,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2的质量不变的是( )
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
16.铀是自然界中能够找到的最重元素.地球上存量最多的是92238U,关于92238U下列说法正确的是( )
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
6.下列溶液颜色的变化不是因为化学反应而引起的( )
| A. | 实验室的浓硝酸通常显黄色 | B. | Fe(NO3)2溶液中滴入稀盐酸 | ||
| C. | NO2气体遇湿润的淀粉KI试纸变蓝 | D. | 将活性炭加入红墨水中褪色 |
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
10.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
11.氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
③下列关于合成氨说法正确是B(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.

 、C
、C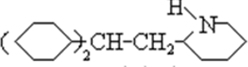 .
.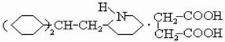 .
.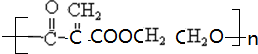 .
. .
.
 +H2O.
+H2O.