题目内容
12.分别将100g钠、镁、铝分别与100mL 0.1mol/L的硫酸溶液反应,所生成的氢气的量的关系为( )| A. | 一样多 | B. | 铝最多 | C. | 钠最多 | D. | 钠最少 |
分析 题中涉及到的化学方程式有①2Na+H2SO4=Na2SO4+H2↑,②Mg+H2SO4=MgSO4+H2↑,③2Al+3H2SO4=Al2(SO4)3+3H2↑,④2Na+2H2O=2NaOH+H2↑,根据方程式得关系式,2Na~H2SO4~H2,2Na~2H2O~H2,2Mg~2H2SO4~2H2,2Al~3H2SO4~3H2,盐酸不足,Mg、Al生成氢气相当,但小于钠与水反应生成的氢气,以此解答.
解答 解:Na、Mg、Al各100g,物质的量分别为:$\frac{100g}{23g/mol}$、$\frac{100g}{24g/mol}$、$\frac{100g}{27g/mol}$,n(H2SO4)=0.1L×0.1mol/L=0.01mol,根据方程式2Na+H2SO4=Na2SO4+H2↑,Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,Na、Mg、Al分别消耗硫酸的物质的量为:$\frac{100}{23}$×$\frac{1}{2}$mol、$\frac{100}{24}$mol、$\frac{100}{18}$mol,显然钠镁铝三者硫酸的量都不足,2Mg~2H2SO4~2H2,2Al~3H2SO4~3H2,硫酸完全反应,Mg、Al生成氢气为0.01mol,
2Na~H2SO4~H2,过量钠和水反应,2Na~2H2O~H2,所以100g钠可生成$\frac{100}{23}$×$\frac{1}{2}$mol氢气,
所以镁铝产生的氢气一样多,则钠生成氢气最多,
故选C.
点评 本题考查化学方程式的相关计算,侧重考查钠的性质,注意钠可与酸、水反应的特点比较生成氢气的多少是解答关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列反应的离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
11.常温下,有下列4中溶液,下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1 mol/L-1 CH3COOH溶液 | pH=3 CH3COOH 溶液 | 0.1 mol/L-1 NaOH溶液 | pH=11 NaOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ①稀释到原来的100倍后,pH与②相同 | |
| C. | ①与③混合,若溶液pH=7,则两溶液的体积:③>① | |
| D. | ②与④混合,若溶液pH=7,则两溶液的体积:④>② |
7.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )
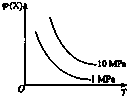

| A. | 2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应) | |
| B. | H2(g)+I2(g)?2HI(g)(正反应为放热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应) | |
| D. | 2SO2(g)+O2(g)?2SO3(正反应为放热反应) |
1.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则有机物的组成为一定CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的百分含量越大 | |
| C. | 气态烃CxHy在O2充分燃烧,反应前后气体体积不变(温度>100℃),则y=4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中碳的百分含量越高 |
2.下列体系中,离子能大量共存的是( )
| A. | 无色透明的酸性溶液:MnO4-、K+、C1-、SO42- | |
| B. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| C. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、I- | |
| D. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- |
 如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.