题目内容
7.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )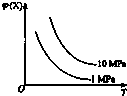
| A. | 2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应) | |
| B. | H2(g)+I2(g)?2HI(g)(正反应为放热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应) | |
| D. | 2SO2(g)+O2(g)?2SO3(正反应为放热反应) |
分析 根据图示信息知道:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向,据此回答判断.
解答 解:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向.
A、该反应是吸热反应,且逆向是气体系数和减小的方向,符合题意,故A正确;
B、该反应是放热反应,且前后气体系数和相等的,压强不会引起该平衡的移动,不符合题意,故B错误;
C、该反应是放热反应,不符合题意,故C错误;
D、该反应是放热反应,且逆向是气体系数和增大的方向,不符合题意,故D错误;
故选A.
点评 本题考查学生影响化学平衡移动的因素:温度、压强等,注意图象题的分析方法,固定变量法是常用的处理方式,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
2.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
| A. | 丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的 | |
| B. | 甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的 | |
| D. | 丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
12.分别将100g钠、镁、铝分别与100mL 0.1mol/L的硫酸溶液反应,所生成的氢气的量的关系为( )
| A. | 一样多 | B. | 铝最多 | C. | 钠最多 | D. | 钠最少 |
19.某有机物的蒸气,完全燃烧时消耗的氧气体积和生成的二氧化碳体积都是它本身体积的2倍.该有机物可能是( )
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
17.桶烯(Barrelene)结构简式如图所示,则下列有关说法一定正确的是( )
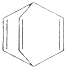

| A. | 0.1mol桶烯完全燃烧需要消耗氧气22.4L | |
| B. | 桶烯在一定条件下能发生加成反应,不能发生加聚反应 | |
| C. | 桶烯二氯取代产物只有三种 | |
| D. | 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
