题目内容
17.白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得.相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26kJ•mol-1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ•mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g)△H3
则△H3=+2821.6kJ•mol-1.
分析 根据盖斯定律将已知热化学方程式①+②×6得2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g),焓变做相应运算求解.
解答 解:①2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26kJ•mol-1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ•mol-1
有盖斯定律可知,①+②×6得2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g),
所以其反应热△H3=△H1+6×△H2=+3359.26kJ•mol-1+6×(-89.61kJ•mol-1)=+2821.6 kJ•mol-1;
故答案为:+2821.6.
点评 本题考查利用盖斯定律计算反应热,正确分析出已知反应与目标反应的关系是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
15.短周期主族X、Y、Z、W、Q的原子序数依次增大,X+中只含有1个质子,Y原子的最外层电子数是内层电子数的2倍,Z 和 Q同主族且能形成两种常见化合物QZ2、QZ3,W是短周期中原子半径最大的元素.下列叙述正确的是( )
| A. | Y3X8分子中,极性键和非极性键的个数比为8:3 | |
| B. | Z和Q形成的两种化合物中只有一种属于酸性氧化物 | |
| C. | 25℃时,若WZX溶液中的C(OH-):C(H+)=1012,则该溶液的pH=13 | |
| D. | Q元素在自然界中不能以游离态存在 |
16.将燃着的H2S不断通入盛有一定量O2的集气瓶中.当火焰熄灭后继续通入H2S,发生的主要反应是( )
| A. | 2H2S+O2→2S+2H2O | B. | 2H2S+3O2→2SO2+2H2O | ||
| C. | 2H2S+SO2→3S+2H2O | D. | 2SO2+O2→2SO3 |
12.分别将100g钠、镁、铝分别与100mL 0.1mol/L的硫酸溶液反应,所生成的氢气的量的关系为( )
| A. | 一样多 | B. | 铝最多 | C. | 钠最多 | D. | 钠最少 |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
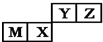

| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
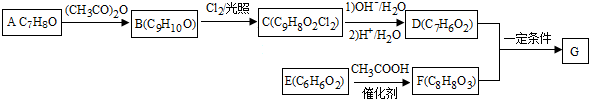

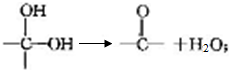

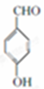
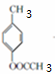 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$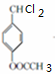 +2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH
+2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH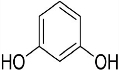 +CH3COOH$\stackrel{催化剂}{→}$
+CH3COOH$\stackrel{催化剂}{→}$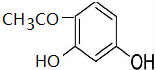 +H2O
+H2O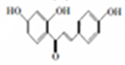
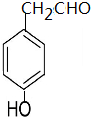 (填结构简式)
(填结构简式)