题目内容
1.下列说法正确的是( )| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则有机物的组成为一定CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的百分含量越大 | |
| C. | 气态烃CxHy在O2充分燃烧,反应前后气体体积不变(温度>100℃),则y=4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中碳的百分含量越高 |
分析 A、根据质量守恒定律;
B、相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中碳原子数目大,但碳元素的含量不一定大;
C、根据方程式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g)来判断;
D、等质量的烃完全燃烧时,烃分子中的含H量越大,耗氧量越大.
解答 解:A、生成物中含有碳、氢元素,依据质量守恒定律可知该物质中一定含有碳、氢元素,氧元素不能确定,无法确定有机物的组成,故A错误;
B、相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中碳原子数目大,但碳元素的含量不一定大,如甲烷与乙烷,故B错误;
C、温度>100℃,生成的水为气态,根据CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),如果反应前后气体体积不变则有:1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,解得y=4,故C正确;
D、由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,故D错误;
故选:C.
点评 本题考查有机物燃烧,涉及耗氧量、有机物组成、体积变化等,难度不大,注意根据燃烧通式进行理解,注意规律的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.碳元素的一种单质的化学式为C68,则关于C68的叙述错误的是( )
| A. | 属分子晶体 | B. | 可溶于CCl4 | C. | 固态可导电 | D. | 熔点高于C60 |
12.分别将100g钠、镁、铝分别与100mL 0.1mol/L的硫酸溶液反应,所生成的氢气的量的关系为( )
| A. | 一样多 | B. | 铝最多 | C. | 钠最多 | D. | 钠最少 |
13.卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )

| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
10.1mol有机物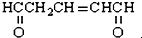 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
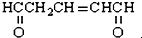 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol 2 mol | B. | 1 mol 4 mol | C. | 3 mol 2 mol | D. | 3 mol 4 mol |
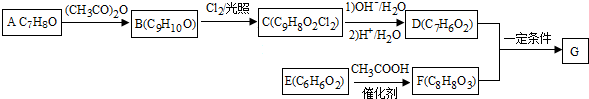
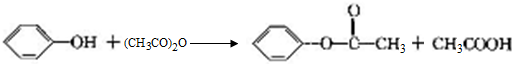
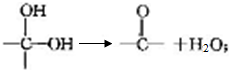

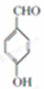
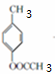 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$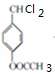 +2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH
+2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH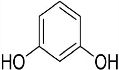 +CH3COOH$\stackrel{催化剂}{→}$
+CH3COOH$\stackrel{催化剂}{→}$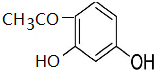 +H2O
+H2O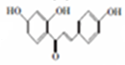
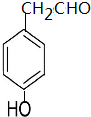 (填结构简式)
(填结构简式)