题目内容
10.下列反应的离子方程式书写正确的是( )| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
分析 A.次氯酸具有强氧化性,能够氧化亚硫酸钙;
B.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子;
C.大理石的主要成分为碳酸钙,碳酸钙和醋酸都需要保留化学式;
D.亚铁离子的还原性大于溴离子,等物质的量的二者反应,亚铁离子优先反应,溴离子只有一半被氧化.
解答 解:A.向次氯酸钙溶液中通入过量的二氧化硫,亚硫酸盐不可能存在次氯酸溶液中,要发生氧化还原反应,正确的离子方程式为:2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO42-,故A错误;
B.Fe3O4与稀硝酸反应生成铁离子和一氧化氮气体,正确的离子反应为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,故B错误;
C.大理石溶于醋酸中,反应生成醋酸钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故C正确;
D.氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性大于溴离子,所以氯气先氧化亚铁离子,等物质的量的FeBr2和Cl2反应时,正确的离子方程式为:2Fe2++2Cl2+2Br-═2Fe3++4Cl-+Br2,故D错误.
故选C.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
16.某小组以醋酸为例探究弱酸的性质.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
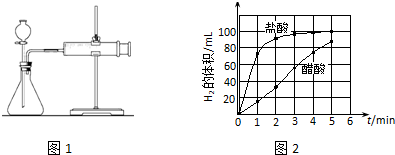
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
1.下列化合物的同分异构体数目与C3H8O的同分异构体数目相同的是( )
| A. | C3H6 | B. | C4H8 | C. | C6H4Cl2 | D. | C5H12 |
18.下列生产、生活中的事实不能用金属活动性顺序表解释的是( )
| A. | 铝制器皿不宜盛放酸性食物 | |
| B. | 电解饱和食盐水阴极产生氢气得不到钠 | |
| C. | 铁制容器盛放和运输浓硫酸 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
15.短周期主族X、Y、Z、W、Q的原子序数依次增大,X+中只含有1个质子,Y原子的最外层电子数是内层电子数的2倍,Z 和 Q同主族且能形成两种常见化合物QZ2、QZ3,W是短周期中原子半径最大的元素.下列叙述正确的是( )
| A. | Y3X8分子中,极性键和非极性键的个数比为8:3 | |
| B. | Z和Q形成的两种化合物中只有一种属于酸性氧化物 | |
| C. | 25℃时,若WZX溶液中的C(OH-):C(H+)=1012,则该溶液的pH=13 | |
| D. | Q元素在自然界中不能以游离态存在 |
2.下列叙述正确的是( )
| A. | 含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O═2S↓+4OH- | |
| C. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3 | |
| D. | 滴加KSCN显红色的溶液中存在:NH4+、K+、C1-、I- |
19.碳元素的一种单质的化学式为C68,则关于C68的叙述错误的是( )
| A. | 属分子晶体 | B. | 可溶于CCl4 | C. | 固态可导电 | D. | 熔点高于C60 |
12.分别将100g钠、镁、铝分别与100mL 0.1mol/L的硫酸溶液反应,所生成的氢气的量的关系为( )
| A. | 一样多 | B. | 铝最多 | C. | 钠最多 | D. | 钠最少 |