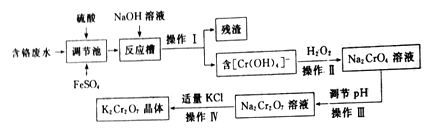
题目内容
【题目】在一定温度下,把3.0molM和2.5mol N混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) ![]() XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
A. X的值为1 B. M的平均反应速率为0.15 molL-1·min-1
C. M的转化率为60% D. 平衡时P的浓度为0.25 molL-1
【答案】C
【解析】A项,因为5min后反应达到平衡,容器内的压强变小,所以该反应是气体分子数减小的反应,故X=1,A正确;B项,B项,Q的平均反应速率为0.1molL-1min-1,速率之比=化学计量数之比,所以M的平均反应速率为0.15 molL-1min-1,B正确;C项,5min内反应的M为0.15 molL-1min-1×5min×2L=1.5 mol,故转化率为50%,C错误;D项,Q的平均反应速率为0.1molL-1min-1,速率之比=化学计量数之比,所以P的平均反应速率为0.05 molL-1min-1,故平衡时P的浓度为0.05 molL-1min-1×5min=0.25 molL-1,D正确。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣被还原成Mn2+。
Ⅰ.产品制备与检验:用图20装置制备NaNO2
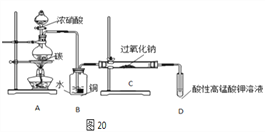
(1)写出装置A烧瓶中发生反应的化学方程式________________。
(2)B装置的作用是___________;盛浓硝酸的仪器名称为__________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管。在干燥管中盛放的试剂名称为____________。
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)_________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是_________。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数_______。