题目内容
【题目】常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. HR为强电解质
B. 图中四点,水的电离程度:c>b>d>a
C. 若常温时0.1mol/LHR溶液的电离度为1%,则常温时R-的水解常数约为10-9
D. b点溶液中存在c(Na+)=c(R-)+c(HR)
【答案】C
【解析】A. 根据图像,c点是完全反应的点,溶液的pH>7 ,说明生成的盐发生了水解,HR为弱电解质,故A错误;B. 图中四点,c点盐的浓度最大,水解程度最大,水的电离程度最大,ad2点中HR和氢氧化钠的物质的量相等,但HR为弱酸对的抑制程度较小,因此水的电离程度:a>d,故B错误;C. 若常温时0.1mol/LHR溶液的电离度为1%,则HA的电离常数Ka=1×10-5,常温时R-的水解常数K=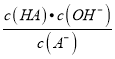 =
=![]() =
=![]() =10-9,故C正确;D. b点溶液中存在HR和NaR,根据物料守恒,c(Na+)<c(R-)+c(HR),故D错误;故选C。
=10-9,故C正确;D. b点溶液中存在HR和NaR,根据物料守恒,c(Na+)<c(R-)+c(HR),故D错误;故选C。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目