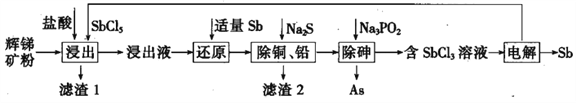
��Ŀ����
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪����
��2NO+Na2O2=2NaNO2
��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4������ԭ��Mn2+��
��Ʒ�Ʊ�����飺��ͼ20װ���Ʊ�NaNO2
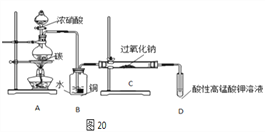
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ________________��
��2��Bװ�õ�������___________��ʢŨ�������������Ϊ__________��
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ�����̼���ƺ��������ƣ�Ϊ�Ʊ�������NaNO2��Ӧ��B��Cװ�ü�����һ������ܡ��ڸ������ʢ�ŵ��Լ�����Ϊ____________��
��4�������ʵ�飬����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_________��
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ����������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������_______��
���𰸡� C+4HNO4(Ũ)![]() CO2��+4NO2��+2H2O ��NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO�� ��Һ©�� ��ʯ�ң���2�֣� ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬�μ���������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2 A��C 86.25%��0.8625
CO2��+4NO2��+2H2O ��NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO�� ��Һ©�� ��ʯ�ң���2�֣� ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬�μ���������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2 A��C 86.25%��0.8625
��������������1��װ��A��C��Ũ���ᷴӦ�Ļ�ѧ����ʽ�ķ���ʽΪ��C+4HNO3��Ũ��CO2��![]() +4NO2��+2H2O��
+4NO2��+2H2O��
��2������ʵ��װ�ÿ�֪��װ��C�з�����Ӧ��2NO+Na2O2=2NaNO2����װ��B�������ǽ�NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO������������ṹ��֪��ʢŨ�������������Ϊ��Һ©����
��3��Ϊ�Ʊ�����NaNO2����Ҫ������װ��C�������еĶ�����̼��ˮ��ȥ����ʯ���ܹ����ն�����̼��ˮ���ʿ���ѡ�ü�ʯ�ң�
��4������������Ϣ��֪������KMnO4��Һ�ɽ�NO2-����ΪNO3-��MnO4-��ԭ��Mn2+���ݴ˿���Ƴ������������Ƶķ���Ϊ��ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ���μ���1-2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2��
������һ��ʵ���������ĵ����Ը��������Һ���ƫ�ᵼ�²������ƫ�ߣ�A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����±�Һ��ϡ�ͣ��ζ����������ĵı�Һ�����ƫ��A��ȷ��B����ƿ����Ҫ���������ƿϴ����δ�����Ӱ��ⶨ�������B����C���ζ��������Ӷ��������¶���ƫ������ı�Һ���ƫ��C��ȷ��D���ζ����˸��Ӷ������ζ��ܶ���ƫС��������ı�Һ���ƫС����D���ʴ�ΪAC��
��6�����ڵ�һ������ƫ�ߣ�Ӧ�������������������ı�Һƽ�����Ϊ�� ![]() mL=20.00mL��25mL��Ʒ���ĸ�����ص����ʵ���Ϊ��0.1000mol/L��0.02L=0.002mol����250mL��Ʒ��Һ�����ĸ�����ص����ʵ���Ϊ��0.002mol��
mL=20.00mL��25mL��Ʒ���ĸ�����ص����ʵ���Ϊ��0.1000mol/L��0.02L=0.002mol����250mL��Ʒ��Һ�����ĸ�����ص����ʵ���Ϊ��0.002mol��![]() =0.02mol�����ݻ��ϼ۱仯�ɵ÷�Ӧ��ϵʽ��2MnO4-��5NO2-����4.000g��Ʒ�к����������Ƶ����ʵ���Ϊ��0.02mol��
=0.02mol�����ݻ��ϼ۱仯�ɵ÷�Ӧ��ϵʽ��2MnO4-��5NO2-����4.000g��Ʒ�к����������Ƶ����ʵ���Ϊ��0.02mol��![]() =0.05mol������Ϊ69g/mol��0.05mol=3.45g�����Է�Ӧ��Ĺ������������Ƶ���������Ϊ��
=0.05mol������Ϊ69g/mol��0.05mol=3.45g�����Է�Ӧ��Ĺ������������Ƶ���������Ϊ�� ![]() ��100%=86.25%��
��100%=86.25%��