题目内容
19.已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O(1)标出上述反应电子转移的方向和总数
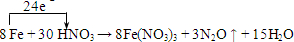 .
.(2)上述反应中+5价的N元素被还原,氧化产物为Fe(NO3)3,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为0.8NA.
分析 (1)Fe失去电子,N得到电子,该反应转移24e-;
(2)N元素的化合价降低,得到电子被还原,而Fe失去电子被氧化,由反应可知,生成3molN2O时转移24mol电子,以此来解答.
解答 解:(1)Fe失去电子,N得到电子,该反应转移24e-,则电子转移方向和数目为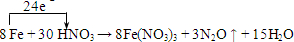 ,
,
故答案为: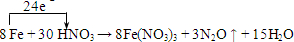 ;
;
(2)N元素的化合价降低,得到电子被还原,+5价的N元素被还原,而Fe失去电子被氧化,氧化产物为Fe(NO3)3,由反应可知,生成3molN2O时转移24mol电子,生成标准状态下的N2O气体2.24L则转移的电子数目为$\frac{2.24L}{22.4L/mol}$×$\frac{24}{3}$×NA=0.8NA,
故答案为:+5价的N;Fe(NO3)3;0.8NA.
点评 本题考查氧化还原反应,为高频考点,把握发反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
10.把石灰石浸入盐酸中,下列措施能使反应速率增大的是( )
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
7.短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )


| A. | Z一定是活泼的金属 | |
| B. | Y的最高价氧化物的水化物是一种强酸 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质跟足量水反应时,有3 mol电子发生转移 |
14.金属是热和电的良好导体,因为它( )
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
4.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评 价 |
| A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | 正 确 |
| B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O=Fe(OH)3↓+3H+ | 正 确 |
| D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
| A. | A | B. | B | C. | C | D. | D |
8.在相同温度相同体积的甲、乙两容器中发生反应2SO2(g)+O2(g)═2SO3(g),甲容器中充入1molSO2和1molO2,乙容器充入2molSO2和2molO2.下列叙述错误的是( )
| A. | 化学反应速率:乙>甲 | B. | 平衡后O2的浓度:乙>甲 | ||
| C. | 平衡后SO2的转化率:乙>甲 | D. | 平衡后混合气体的密度:乙>2甲 |
9.有关比较中,大小顺序排列不正确的是( )
| A. | 物质的熔点:石英>食盐>冰 | |
| B. | 热稳定性:H2O>HI>HBr>HCl | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 微粒的半径:Cl->Na+>Mg2+>Al3+ |
 .
.