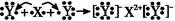题目内容
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式:
_____________________________________________________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____ ________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2  Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_________________________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
(1)第二周期第ⅥA族 (2) HClO4 H2S
(3) H2S(g)+ O2(g)=H2O(l)+SO2(g) ΔH=-a kJ·mol-1
O2(g)=H2O(l)+SO2(g) ΔH=-a kJ·mol-1
(4) 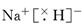 NaH+H2O=NaOH+H2↑ (5) Fe2++2e-=Fe 钠 β-Al2O3
NaH+H2O=NaOH+H2↑ (5) Fe2++2e-=Fe 钠 β-Al2O3
解析试题分析:由题意知这几种元素分别是X是H;Y是O;Z是Na;M是S;G是Cl.(1) O在元素周期表中的位置为第二周期第ⅥA族.(2)在这几种元素中,最高价氧化物对应的水化物酸性最强的是Cl元素对应的HClO4,非金属气态氢化物还原性最强的是S元素的氢化物H2S。(3)X2M燃烧热的热化学方程式为H2S(g)+3/2O2(g)=H2O(l)+SO2(g) ΔH=-a kJ/mol. (4)NaH的电子式为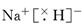 .它与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑。(5)放电时Fe为负极,负极的电极反应为Fe-2e-=Fe2+.C棒为正极。在正极上发生反应Fe2++2e-=Fe。充电时钠与电源的负极相连,在该电极上发生反应Na++e-=Na。该电池的电解质为β-Al2O3。
.它与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑。(5)放电时Fe为负极,负极的电极反应为Fe-2e-=Fe2+.C棒为正极。在正极上发生反应Fe2++2e-=Fe。充电时钠与电源的负极相连,在该电极上发生反应Na++e-=Na。该电池的电解质为β-Al2O3。
考点:考查元素及化合物的推断及电化学的反应原理的知识。

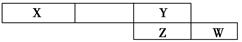
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为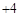 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
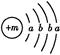 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。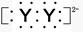
 2Y-+Z↓
2Y-+Z↓