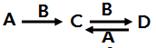题目内容
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为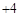 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
(1)2 (1分) OF2 (1分)
(2)AD (2分)
(3)BD (2分)
(4)1×10—4 (2分)
(5)B<A<C (2分)
(6)AC (2分)
解析试题分析:(1)氯原子最外层电子排布式为3S2SP5,3S,3P两种轨道,故有2种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,应该为+2价,该化合物的分子式 OF2 。
(2)A中CS2中各元素的化合价为负的说明得电子能力强,非金属性强,正确。B.气态氢化物的稳定性越强其对应元素的非金属性越强,正确。C.两中元素在周期表中的位置无法进行判断,错误。D.最高价含氧酸的酸性硫酸强于碳酸,正确。选ABD。
(3)A.由于F原子半径小于氯,故键长HF<HCl,故错误。B中稳定性:HF>HCl,正确。C.酸性:HF<HCl,不能通过氢化物水溶液的酸性强弱判断,错误。D.沸点:HF>HCl,由于前者分子间存在氢键,故正确。
(4)根据表中数据在30°C、pH=4.0条件下,O3的分解速率为0.0216/(2*108)=1×10—4mol/ (L·min)。
(5)根据表中数据,O3在下列条件下分解速率由小到大的顺序为B<A<C .
(6)正反应是放热反应,A中降低温度平衡正向移动,K增大,正确。B中应该是K=K1*K2,错误。C.适当升温,平衡右移,使溴氧的量较多,可延长消毒,正确。D中K2不变,只与温度有关,错误。
考点:本题考查元素非金属性的判断,化学平衡常数及化学反应速率等知识。

有关元素X、Y、Z、W的信息如下:
| 元素 | 有关信息 |
| X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
| Y | 原子半径为0.102 nm,其原子核外电子排布为: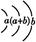 |
| Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W | 所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)W在元素周期表中的位置是 。
(2)Y与W相比,非金属性较强的是 (填元素符号),下列事实能证明这一结论的是 (填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z
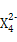 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。①Z
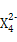 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明) 。
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。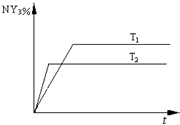
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。

 Fe + 2ZG
Fe + 2ZG