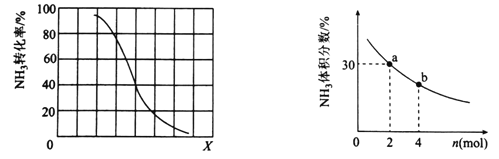
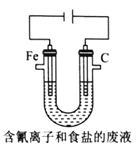
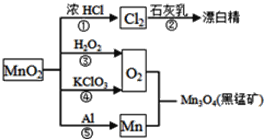
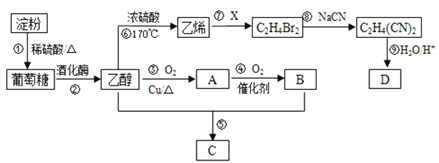
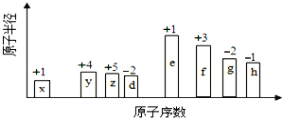
题目内容
【题目】下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是
A.![]()
B.![]()
C.1s22s22p3
D.![]()
【答案】C
【解析】
试题A.表示N原子核外有7个电子,这7个电子位于原子核外2个电子层,电子数分别是2、5,不能表明同一层电子的能量的差异,错误。B.表示N原子最外层有5个电子,不能确定电子能量的差异,错误。C.表示N原子7个电子分别位于三个电子亚层,每个电子亚层的一个轨道最多具有2个电子,可以看出同一电子层的不同亚层的能量不同,正确。D.N原子核外有7个电子,它们在原子核外排布时遵循能量最低原理、保利不相容原理和洪特规则,原子尽可能成单排列,而且自旋方向相同,这样可以使原子的能量最低,因此能级排布图有误,错误。

 阅读快车系列答案
阅读快车系列答案【题目】将高温水蒸气通到硫氰化钾的表面,会发生反应:4KSCN + 9H2O(g) → K2CO3 + K2S + 3CO2 + 3H2S + 4NH3完成下列填空:
(1)上述反应所涉及的各元素中,离子半径最大的是_____________(填离子符号);属于第二周期元素的非金属性由强到弱的顺序为_________________。
(2)上述反应所涉及的各物质中,属于非电解质的是_________________。
(3)写出CO2的电子式____________,其熔沸点低的原因是___________________________。
(4)已知物质的量浓度均为0.10 mol/L的K2CO3和K2S溶液pH如下:
溶液 | K2CO3 | K2S |
pH | 11.6 | 12.5 |
K2CO3水溶液呈碱性的原因是______________________________(用离子方程式表示)。从表中数据可知,K2CO3溶液中c(CO32-)_______K2S溶液中的c(S2—)(填“>”“<”或“=”)。
(5)K2S接触潮湿银器表面,会出现黑色斑点(Ag2S),其原理如下:____K2S + ____Ag + _____O2 + _____H2O → _____Ag2S + _____KOH
①配平上述反应________________。
②每消耗标准状况下224 mL O2,转移电子数目为_____________。