题目内容
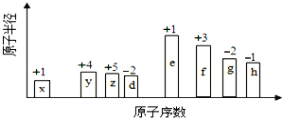
【题目】随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
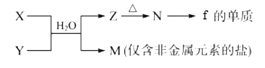
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
【答案】第三周期第ⅢA族O2->Na+HClO4>H2SO4![]() (或
(或![]()
![]() ,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)
,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。根据元素周期表、元素周期律和相关化学用语作答。
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。
(1)f为Al元素,Al在元素周期表的位置是第三周期第IIIA族。
(2)d、e的简单离子依次为O2-、Na+,O2-、Na+具有相同的电子层结构,核电荷数:O2-<Na+,离子半径:r(O2-)>r(Na+)。根据“同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强”,非金属性:S<Cl,最高价氧化物对应水化物的酸性:HClO4>H2SO4。
(3)上述元素组成的常见四原子共价化合物有:C2H2、NH3、H2O2等,它们的电子式依次为![]() 、
、![]() 、
、![]() 。
。
(4)Na(s)在O2(g)中燃烧生成Na2O2(s),反应的热化学方程式为Na(s)+![]() O2(g)=
O2(g)=![]() Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
(5)由f、h组成的物质X为AlCl3,由x、z形成的化合物Y为NH3;X与Y在水溶液中反应生成M和Z,M是仅含非金属元素的盐,M为NH4Cl,Z为Al(OH)3,Al(OH)3受热分解生成的N为Al2O3,电解熔融Al2O3生成Al和O2。
①X溶液与Y溶液反应的化学方程式为:AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl(或AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl),反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(或Al3++3NH3·H2O=Al(OH)3↓+3NH4+)。
②工业上电解熔融Al2O3制备Al,工业上制备Al的化学方程式为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。