题目内容
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
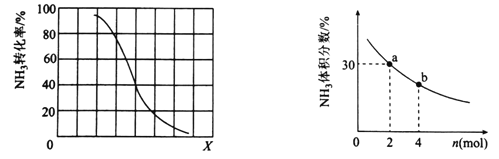
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
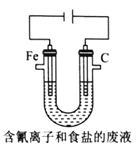
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
【答案】c+6d-3a-2b 11 压强 0.025 = 2 5 20H- 2 l 5 Cl- H2O 112
【解析】
运用盖斯定律计算反应热;依据勒夏特列原理分析平衡的移动方向;根据得失电子数目守恒规律配平氧化还原反应。
(1) 已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1 ①
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1 ②
2NH3(g) △H2=bkJ·mol-1 ②
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1 ③
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1 ④
根据盖斯定律,③+6![]() ④-3
④-3![]() ①-2
①-2![]() ②得3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g),△H=△H3+6
②得3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g),△H=△H3+6![]() △H4-3
△H4-3![]() △H1-2
△H1-2![]() △H2= c+6d-3a-2b kJ·mol-1,
△H2= c+6d-3a-2b kJ·mol-1,
故答案为:c+6d-3a-2b;
(2) 1.0mol· L -1NaCIO溶液中,c(ClO-)= 1.0mol· L -1,已知ClO-+H2 O=HClO+OH-,该水解反应的平衡常数为K=c(HClO) c(OH-)/ c(ClO-)= c2(OH-)=1.0×10-6mol·L-1,c(OH-)= 1.0×10-3mol·L-1,则c(H+)=10-14/10-3=10-11,pH=11,
故答案为:11;
(3) ①根据图示,X越大转化率越小,平衡逆向移动,该反应为吸热,温度升高平衡正向移动,增大压强,平衡逆向移动,
故答案为:压强;
②设 10min时,反应的氨气的物质的量为x
CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g)
HCN(g)+3H2 (g)
开始(mol) 2 2 0 0
反应(mol) x x x 3x
a点(mol) 2-x 2-x x 3x
则(2-x)/2-x+x+3x=30%,x=0.5,v(CH4)=(0.5mol/2L)/10min=0.025 mol·L-1·min-1;平衡常数只和温度有关,所以K(a)=K(b),
故答案为:0.025,=;
③由题干知,0H-参加反应,ClO-被还原成Cl-同时产物中还有水生成,再根据转移电子数相等及原子守恒规律配平得:
2 CN-+5ClO-+20H-====2CO32-+N2↑+5Cl- +H2O;根据反应方程式得,处理2mol CN-消耗5mol ClO-,消耗5molCl2,所以阴极生成5mol氢气,则V(H2)=22.4mol/L![]() 5mol=112L,
5mol=112L,
故答案为:2,5,20H-,2,1,5 Cl-,H2O;112。

【题目】下列关于物质分类的正确组合是 ( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | (NH4)2CO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | H2O |
C | Ba(OH)2 | H2CO3 | CaCl2 | CO2 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D