题目内容
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)

A. 反应⑤说明该条件下铝的还原性强于锰
B. 反应①②③④⑤均属于氧化反应和离子反应
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①中氧化剂与还原剂的物质的量之比为1∶4
【答案】A
【解析】
根据氧化还原反应和离子反应的本质和规律进行分析。
A.反应⑤是置换反应,铝是还原剂,锰是还原产物,所以铝的还原性强于锰,故A正确;
B.①②③④⑤五个反应中都有元素的化合价发生了变化,所以都是氧化还原反应。反应④⑤不是在水溶液中发生的反应,所以不是离子反应,故B错误;
C.反应③中氧元素的化合价是从-1升高到0,而反应④中氧元素的化合价是从-2升高到0,所以两者转移的电子数之比为1∶2,故C错误;
D.反应①的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,参加反应的HCl中有一半被氧化,所以氧化剂和还原剂之比为1∶2,故D错误。
MnCl2+Cl2↑+2H2O,参加反应的HCl中有一半被氧化,所以氧化剂和还原剂之比为1∶2,故D错误。
正确答案:A。

【题目】社会在飞速发展,环境问题也备受关注,如何减少污染,寻求清洁能源是现代学者研究的方向。
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
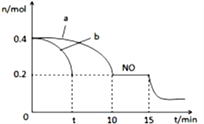
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2s内的平均反应速率v(N2)=_______
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:___。

②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) ![]() 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)△H=________。
4N2(g)+6H2O(g)△H=________。
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
① | 180 | 2:3 | 0.1 |
② | n | 2:3 | 5 |
③ | 350 | m | 5 |
表中剩余的实验数据:n=________,m=________.
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是______________(填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O