题目内容
常温下,下列说法正确的是
| A.往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 |
| B.物质的量浓度均为0.1mol?Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)>c(CH3COOˉ) |
| C.某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)> c(OHˉ) |
| D.在pH=4的氯化铵溶液中c(H+)+ c(NH4+)=" c(Clˉ)+" c(OHˉ) |
BD
试题分析:醋酸是弱酸,其溶液显酸性,加水稀释时溶液的酸性减弱,则溶液中c(H+)减小,但是水的离子积不变,则溶液中的c(OHˉ)增大,故A错误;混合后得到CH3COONa溶液,因为酸碱恰好完全中和,CH3COONa是强碱弱酸盐,钠离子不水解,醋酸根离子部分水解,则混和后溶液中c(Na+)>c(CH3COOˉ),故B正确;NH4Cl是强酸弱碱盐,其电离程度远远大于水,氯离子不能水解,铵根离子部分水解,消耗水电离出的氢氧根离子,使水的电离平衡右移,则c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ),故C错误;氯化铵溶液中含有的离子有Clˉ、NH4+、H+、OHˉ,根据电荷守恒原理可知,c(H+)+c(NH4+)=" c(Clˉ)+" c(OHˉ),故D正确。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
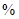 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。