题目内容
铁是地壳中含量第二的金属元素,其单质、合金化合物在生产生活中的应用广泛。
(一)工业废水中有一定量的Cr2O72--和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是____________________________________________________。
(2)阴极附近溶液pH升高的原因是___________(用电极反应式解释);溶液中同时生成的沉淀还有___________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁涉及的主要生产流程如下:
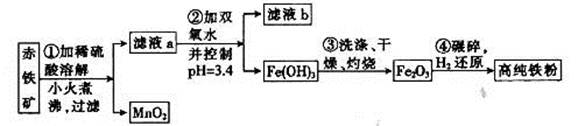
已知:①某赤铁矿石含60.0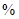 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
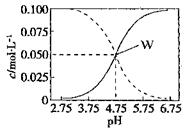
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:

(3)步骤②中加双氧水的目的是__________________,pH控制在3.4的作用是_______________________;已知25℃时,Ksp[Cu(OH) 2] =2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。
(4)如何判断步骤③中沉淀是否洗涤干净?_____________________________________。
(一)工业废水中有一定量的Cr2O72--和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是____________________________________________________。
(2)阴极附近溶液pH升高的原因是___________(用电极反应式解释);溶液中同时生成的沉淀还有___________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁涉及的主要生产流程如下:

已知:①某赤铁矿石含60.0
 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:

(3)步骤②中加双氧水的目的是__________________,pH控制在3.4的作用是_______________________;已知25℃时,Ksp[Cu(OH) 2] =2.0×10-20,该温度下反应:Cu2++2H2O
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。(4)如何判断步骤③中沉淀是否洗涤干净?_____________________________________。
(14分)
(1)提供还原剂Fe2+(2分)
(2)2H++2e-=H2↑ (或2H2O-2e-= H2↑+2OH-)(2分);Fe(OH)3 (1分)
(3)将溶液中的Fe2+氧化成Fe3+(1分);使溶液中的Fe3+完全沉淀,而其他金属离子不沉淀(1分);
5.0×10-9(2分)
(4)取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无白色沉淀生成,则表明沉淀已洗净(2分)
(1)提供还原剂Fe2+(2分)
(2)2H++2e-=H2↑ (或2H2O-2e-= H2↑+2OH-)(2分);Fe(OH)3 (1分)
(3)将溶液中的Fe2+氧化成Fe3+(1分);使溶液中的Fe3+完全沉淀,而其他金属离子不沉淀(1分);
5.0×10-9(2分)
(4)取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无白色沉淀生成,则表明沉淀已洗净(2分)
试题分析:
(1)Fe作电极的目的是提供还原剂Fe2+与Cr2O72-反应。
(2)H+在阴极放电:2H++2e-=H2↑,导致附近溶液pH升高;
附近溶液pH升高使得Fe3++3H2O
 Fe(OH)3+3H+,平衡正移出现Fe(OH)3沉淀,
Fe(OH)3+3H+,平衡正移出现Fe(OH)3沉淀,(3)根加双氧水的目的是将溶液中的Fe2+氧化成Fe3+,通过调节pH到3.4除去Fe3+;Ksp[Cu(OH) 2] =c(Cu2+)×c2(OH-)=2.0×10-20, K= c2(H+)/ c(Cu2+)=K2W/ Ksp[Cu(OH) 2]= 5.0×10-9。
(4)检验方法:取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无白色沉淀生成,则表明沉淀已洗净

练习册系列答案
相关题目

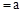 的CH3COOH稀溶液与pH
的CH3COOH稀溶液与pH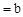 的NaOH稀溶液等体积混合,下列判断错误
的NaOH稀溶液等体积混合,下列判断错误 ,则
,则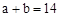
 ,则c
,则c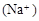 <c
<c