题目内容
对于室温下pH=3的醋酸,下列叙述正确的是
| A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强 |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变 |
| D.与等体积pH=11的NaOH溶液混合后,pH=7 |
BC
试题分析:醋酸溶液存在如下平衡:CH3COOH
 H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
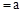 的CH3COOH稀溶液与pH
的CH3COOH稀溶液与pH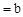 的NaOH稀溶液等体积混合,下列判断错误
的NaOH稀溶液等体积混合,下列判断错误 ,则
,则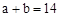
 ,则c
,则c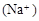 <c
<c

 H++A-
H++A-
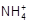 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)