题目内容
下列溶液中各微粒的浓度关系不正确的是
| A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③ |
| B.常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL |
| C.25℃时,浓度均为0.1 mol·L-1的NH3·H2O、NH4Cl溶液等体积混合,所得溶液显碱性:c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-) |
| D.浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
D
试题分析:pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4Cl和(NH4)2SO4水解程度相同,则c(NH4+)相同,正确顺序为①=②>③,故A正确;选项B中如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml,B正确;C中溶液显碱性,说明氨水的电离程度大于NH4+的水解程度,则c(Cl-)>c(NH3·H2O)。根据电荷守恒可知,c(NH4+)+c(H+)=c(Cl-)+c(OH-),因此c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-),C正确;D中根据电荷守恒可知,c(CH3COO-)+ c(OH-)=c(Na+)+c(H+),根据物料守恒可知2c(Na+)=c(CH3COOH)+c(CH3COO-),则c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),D不正确,答案选D。
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合题意灵活运用即可。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目

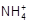 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)