题目内容
【题目】下列关于葛根素( )的说法,正确的是
)的说法,正确的是
A.0.1 mol 葛根素完全燃烧,生成 22.4L(标准状况)H2O
B.1mol 葛根素与溴水反应,最多消耗 2.5mol Br2
C.一定条件下,葛根素能发生氧化、消去及水解等反应
D.与足量 H2 发生加成反应,该分子中官能团的种类减少 2 种
【答案】D
【解析】
A.1个葛根素分子中有20个H, 0.1 mol 葛根素完全燃烧,能生成1mol水,但在标准状况下,水不是气体,所以生成的水在标准状况下的体积不是22.4L,A错误;
B.葛根素分子中有酚羟基,在酚羟基的邻对位碳原子上的氢原子可以被溴原子取代,葛根素分子中还有碳碳双键,可以和溴发生加成反应,所以1mol 葛根素与溴水反应,最多消耗 4mol Br2,B错误;
C.葛根素分子中有羟基,能发生氧化和消去反应,但没有酯基、卤素原子和肽键等,所以不能发生水解反应,C错误;
D.葛根素分子中的苯环、羰基和碳碳双键都可以和氢气加成,葛根素与足量 H2 发生加成反应后,羰基转变为羟基,碳碳双键变成碳碳单键,所以分子中官能团的种类减少 2 种,D正确;
故选D。

 名校课堂系列答案
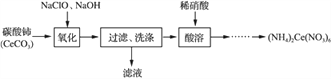
名校课堂系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。

已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
【题目】一定温度下,10mL0.40molL-1H2O2在MnO2作用下发生反应 :2H2O2 ( aq)=2H2O(l )+O2( g) △H <0, 不同时刻测定生成O2的物质的量如下表所示 :
t/min | 0 | 3 | 6 | 10 | ……. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)
A.升高温度,可加快H2O2 的分解速率
B.若增大溶液起始浓度,则收集到 0.0 008 mol O2 的时间会小于3 min
C.反应至 6min 时,溶液 中 c(H2O2)=0.2mol L-1
D.反应至 12min 时,H2O2分解率为 65%