题目内容
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
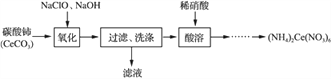
①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
【答案】 C CeCO3+NaClO+2NaOH===CeO2+NaCl+Na2CO3+H2O 取少量最后一次洗涤液于试管中,向其中滴加AgNO3溶液,若不产生白色沉淀,说明CeO2已经洗涤干净 NH4MnPO4·2H2O
n(NH)=n(NH3) =![]() =0.003 mol
=0.003 mol
n(Mn2+)=3n(Mn3O4)=3×![]() =0.003 mol
=0.003 mol
n(PO![]() )=
)=![]() =0.003 mol
=0.003 mol
m(H2O)=![]() -0.003mol×(18 g·mol-1+55 g·mol-1 + 95 g·mol-1)=0.108 g
-0.003mol×(18 g·mol-1+55 g·mol-1 + 95 g·mol-1)=0.108 g
n(H2O)=![]() =0.006 mol
=0.006 mol
n(NH)∶n(Mn2+)∶n(PO![]() )∶n(H2O) =1∶1∶1∶2
)∶n(H2O) =1∶1∶1∶2
该样品的化学式为NH4MnPO4·2H2O
【解析】(1)复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。A.BaFe2O4由钡离子和高铁酸根离子构成,只含有一种金属离子,不符合;B.NaHSO4是酸式盐,不符合;C.KAl(SO4)2·12H2O由钾离子、铝离子和硫酸根离子和结晶水构成,含有 两种金属离子和一种酸根离子,属于复盐,符合;D.Ag(NH3)2OH是络合物,只含有一种阳离子和一种阴离子,不符合。答案选C;(2)①“氧化”得到CeO2是由CeCO3在氢氧化钠溶液中被NaClO氧化生成CeO2,同时生成NaCl、Na2CO3和水,反应的化学方程式为CeCO3+NaClO+2NaOH=CeO2+NaCl+Na2CO3+H2O;②若CeO2已经洗涤干净,则不再含有氯离子,检验的方法是取少量最后一次洗涤液于试管中,向其中滴加AgNO3溶液,若不产生白色沉淀,说明CeO2已经洗涤干净;(3)样品中:n(NH4+)=4n(NH3)=4×![]() ,n(Mn2+)=
,n(Mn2+)=![]() n(Mn3O4)=
n(Mn3O4)= ![]() ,则a=b,根据化合价可知c=a+b,则(NH4)aMnb(PO4)c·xH2O为(NH4)MnPO4·xH2O,且2.4480g(NH4)MnPO4·xH2O物质的量为0.012mol,则M=
,则a=b,根据化合价可知c=a+b,则(NH4)aMnb(PO4)c·xH2O为(NH4)MnPO4·xH2O,且2.4480g(NH4)MnPO4·xH2O物质的量为0.012mol,则M= ![]() ,则18+55+95+18x=204,解得x=2,样品的化学式为NH4MnPO4·2H2O。
,则18+55+95+18x=204,解得x=2,样品的化学式为NH4MnPO4·2H2O。