题目内容
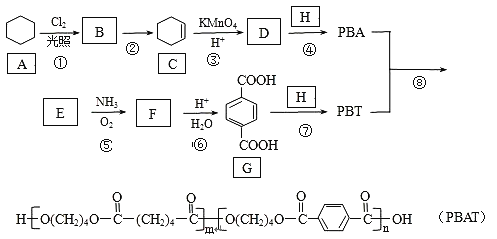
【题目】PBAT(聚己二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:
已知:R—CH3![]() R—CN
R—CN![]() R—COOH
R—COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为______________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备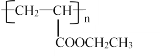 的单体的合成路线(其它试剂可任选)____________。
的单体的合成路线(其它试剂可任选)____________。
【答案】羧基 取代反应 NaOH、C2H5OH(或乙醇),加热 HOOC(CH2)4COOH 1,4-丁二醇 ![]() +2NH3+3O2→
+2NH3+3O2→![]() +6H2O
+6H2O 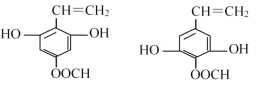 CH2=CHCH3
CH2=CHCH3![]() CH2=CHCN
CH2=CHCN![]() CH2=CHCOOH
CH2=CHCOOH![]() CH2=CHCOOC2H5
CH2=CHCOOC2H5
【解析】
环己烷和氯气发生取代反应生成B,B发生消去反应生成环己烯,可知B是一氯环己烷;环己烯被高锰酸钾氧化为D,D是己二酸;根据![]() ,由
,由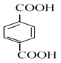 逆推,F是
逆推,F是![]() 、E是
、E是![]() ,由
,由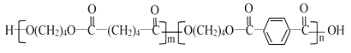 逆推PBA是
逆推PBA是![]() 、PBT是
、PBT是![]() ,则H是HOCH2CH2CH2CH2OH;
,则H是HOCH2CH2CH2CH2OH;
(1)G是 ,官能团的名称为羧基;
,官能团的名称为羧基;
(2)①是环己烷在光照条件下与氯气反应生成一氯环己烷和氯化氢,反应类型为取代反应;反应②是一氯环己烷发生消去反应生成环己烯,所需的试剂和条件是NaOH、C2H5OH(或乙醇),加热;
(3) D是己二酸,结构简式为HOOC(CH2)4COOH;H是HOCH2CH2CH2CH2OH,化学名称为1,4-丁二醇;
(4)反应⑤是![]() 和氨气、氧气反应生成
和氨气、氧气反应生成![]() ,反应化学方程式为
,反应化学方程式为![]() +2NH3+3O2→
+2NH3+3O2→![]() +6H2O;
+6H2O;
(5)M与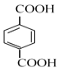 互为同系物,M的相对分子质量比
互为同系物,M的相对分子质量比 大14,说明M多1个CH2;
大14,说明M多1个CH2;
Ⅰ、能与FeCl3发生显色反应,说明含有酚羟基,能发水解反应和银镜反应说明含有酯基、醛基;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH,说明含有2个酚羟基、1个甲酸酯基;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1说明结构对称;
符合条件的N的结构简式有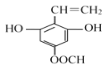 、
、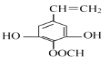 ;
;
(6) ![]() 的单体是CH2=CHCOOC2H5;CH2=CHCH3在
的单体是CH2=CHCOOC2H5;CH2=CHCH3在![]() 条件下生成CH2=CHCN,CH2=CHCN在酸性条件下水解为CH2=CHCOOH,CH2=CHCOOH和乙醇发生酯化反应生成CH2=CHCOOC2H5,合成路线为CH2=CHCH3
条件下生成CH2=CHCN,CH2=CHCN在酸性条件下水解为CH2=CHCOOH,CH2=CHCOOH和乙醇发生酯化反应生成CH2=CHCOOC2H5,合成路线为CH2=CHCH3![]() CH2=CHCN
CH2=CHCN![]() CH2=CHCOOH
CH2=CHCOOH![]() CH2=CHCOOC2H5。
CH2=CHCOOC2H5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案