题目内容
19.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造更高价值化学品,例如:CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+183.4kJ•mol-1
(1)已知该反应在一定条件下能自发进行,则下列说法正确的是②(填代号)
①该反应△S>0,反应条件为低温;
②该反应△S>0,反应条件为高温;
③该反应△S<0,反应条件为低温;
④该反应△S<0,反应条件为高温
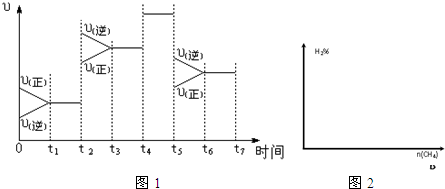
(2)如图1表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同).各阶段平衡时对应的平衡常数如表所示:
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
(3)若该反应在某恒温恒容容器中进行,加入一定量的CO2,在图2中画出随起始CH4物质的量增加,平衡时H2百分含量的变化曲线.
(4)某温度下,向1L恒容密闭容器中通入1mol CO2、1mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α.
①3分钟内用氢气表示的化学反应速率为V(H2)=0.22mol•L-1•min-1,CO2转化率为α=0.33(结果均保留两位有效数字).
②其他条件不变,改为加入3mol CO2、3mol CH4,平衡时CO2的转化率会小于α.(填“大于”、“小于”、“等于”或“无法判断”)
③其他条件不变,如果起始时各物质的浓度如表
| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |
分析 (1)正反应为熵增的反应,△G=△H-T△S<0反应自发进行;
(2)t1~t2处于平衡状态,t2时刻改变条件后,瞬间v正、v逆都增大,且v逆>v正,平衡逆向移动,正反应为气体体积增大的吸热反应,不能是升高温度,改变条件只能是增大压强,温度不变,平衡常数不变化,故K1=K2;
t4时刻改变条件,正逆反应速率都增大,但平衡不移动,故t4时刻所改变的条件是使用催化剂,平衡常数不变,K3=K2;
t5时刻改变条件,正逆反应速率都减小,且v逆>v正,平衡逆向移动,不能是降低压强,改变的条件为降低温度,故K3>K4;
(3)H2的体积分数随投料比[n(CH4)/n(CO2)]的增大而增大,当体积比是3的时候,氢气的体积分数最大,如下图所示:
(4)①3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):1 1
变化量(mol):α α 2α 2α
平衡量(mol):1-α 1-α 2α 2α
根据体积分数方程式计算转化率,再根据v=$\frac{△c}{△t}$计算v(H2);
②其他条件不变,改为加入3mol CO2、3mol CH4,等效为在原平衡的基础上增大压强,平衡逆向移动,平衡时CO2的转化率减小;
③根据K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$计算平衡常数,再计算浓度商Qc,与平衡常数相比判断反应进行方向.
解答 解:(1)正反应为气体物质的量增大的反应,则正反应为△S>0,而△H>0,反应自发进行,△G=△H-T△S<0,故高温下具有自发性,故选:②;
(2)t1~t2处于平衡状态,t2时刻改变条件后,瞬间v正、v逆都增大,且v逆>v正,平衡逆向移动,正反应为气体体积增大的吸热反应,不能是升高温度,改变条件只能是增大压强,温度不变,平衡常数不变化,故K1=K2;
t4时刻改变条件,正逆反应速率都增大,但平衡不移动,故t4时刻所改变的条件是使用催化剂,平衡常数不变,K3=K2;
t5时刻改变条件,正逆反应速率都减小,且v逆>v正,平衡逆向移动,不能是降低压强,改变的条件为降低温度,故K3>K4,
综上分析可知,平衡常数:K1=K2=K3>K4,
故答案为:K1=K2=K3>K4;
(3)H2的体积分数随投料比[n(CH4)/n(CO2)]的增大而增大,当投料比等于化学计量之比13时,平衡体系中氢气的体积分数最大,平衡时H2百分含量的变化曲线: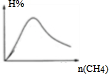 ,故答案为:
,故答案为: ;
;
(4)①3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):1 1 0 0
变化量(mol):α α 2α 2α
平衡量(mol):1-α 1-α 2α 2α
则$\frac{2α}{1-α+1-α+2α+2α}$=25%,解得α=$\frac{1}{3}$=0.33,
v(H2)=$\frac{\frac{2×\frac{1}{3}mol}{1L}}{3min}$=0.22mol/(L.min),
故答案为:0.22;0.33;
②其他条件不变,改为加入3mol CO2、3mol CH4,等效为在原平衡的基础上增大压强,平衡逆向移动,平衡时CO2的转化率减小,即小于α,故答案为:小于;
③容器的体积为1L,利用物质的量代替浓度计算平衡常数,则K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$=$\frac{(\frac{2}{3})^{2}×(\frac{2}{3})^{2}}{\frac{2}{3}×\frac{2}{3}}$=$\frac{4}{9}$,而浓度商Qc=1>K,故反应向逆反应进行,则放出热量,
故答案为:放出.
点评 本题考查化学平衡计算、化学平衡影响因素、平衡常数等,要求学生熟练掌握基础知识,具有分析和解决问题的能力,难度中等.

 教学练新同步练习系列答案
教学练新同步练习系列答案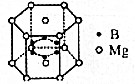 如图所示为离子化合物硼化镁的晶体结构单元,该化合物的化学式可以表示为( )
如图所示为离子化合物硼化镁的晶体结构单元,该化合物的化学式可以表示为( )| A. | MgB2 | B. | Mg5B2 | C. | Mg7B3 | D. | MgB |
CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
葡萄糖溶液滴加3%溴水/55℃:①过量CaCO3/70℃②趁热过滤 ③乙醇 ④悬浊液
抽滤⑤洗涤⑥干燥⑦Ca(C6H11O7)2
葡萄糖溶液$→_{①}^{滴加3%溴水/55℃}$ $\underset{\stackrel{过量CaC{O}_{3}/70℃}{→}}{②}$ $→_{③}^{趁热过滤}$ $→_{④}^{乙醇}$ 悬浊液$→_{⑤}^{抽滤}$ $→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
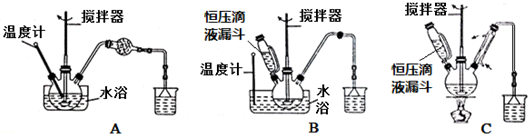
(1)第 ①步中溴水氧化葡萄糖时,下列装置最合适的是B(填序号).
(2)第 ②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,且过量的碳酸钙易除去.
(3)本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应制得葡萄糖酸钙.
(4)第 ③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤或损失产品.
(5)葡萄糖溶液与新制Cu(OH)2悬浊液反应的化学方程式为CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH2OH(CHOH)4COONa+Cu2O↓+3H2O.
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol.
(2)CO2合成尿素的反应为:CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)△H<0.该反应的平衡常数表达式为$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$.
(3)实验室模拟用CO和H2反应来制甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K值为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2(不必化简).
③若6min~8min只改变了某一条件,所改变的条件是加入1mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.