题目内容
3.实验室里用二氧化锰与浓盐酸反应来制取适量的氧气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.已知17.4g MnO2被还原(1)用双线桥标出电子的转移;
(2)参加反应的氯化氢有多少克?
(3)被氧化的氯化氢的物质的量是多少?
分析 n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
(1)该反应中Mn元素化合价由+4价变为+2价,Cl元素化合价由-1价变为0价,转移电子数为2;
(2)根据方程式知,1mol二氧化锰参加反应需要4molHCl,则0.2mol二氧化锰参加反应需要n(HCl)=4n(MnO2)=4×0.2mol=0.8mol,根据m=nM计算参加反应的HCl的质量;
(3)根据方程式知,参加反应的HCl有一半的被氧化,据此计算被氧化的HCl的物质的量.
解答 解:n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
(1)该反应中Mn元素化合价由+4价变为+2价,Cl元素化合价由-1价变为0价,转移电子数为2,用双线桥表示电子转移方向和数目为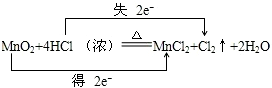 ,
,
答:电子转移方向和数目为 ;
;
(2)根据方程式知,1mol二氧化锰参加反应需要4molHCl,则0.2mol二氧化锰参加反应需要n(HCl)=4n(MnO2)=4×0.2mol=0.8mol,m(HCl)=nM=0.8mol×36.5g/mol=29.2g,
答:参加反应的氯化氢有29.2g;
(3)根据方程式知,参加反应的HCl有一半的被氧化,则被氧化的HCl的物质的量=$\frac{1}{2}$×0.8mol=0.4mol,
答:被氧化的氯化氢的物质的量是0.4mol.
点评 本题考查氧化还原反应有关计算,为高频考点,熟悉方程式中各个物理量之间关系是解本题关键,注意该反应中浓盐酸的作用,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.在实验室可利用浓盐酸与二氧化锰共热制氯气,制备装置中须安装分液漏斗而不能使用长颈漏斗,有关原因叙述错误的是( )
| A. | 防止氯气通过漏斗扩散到空气中造成污染 | |
| B. | 便于控制加入浓盐酸的量 | |
| C. | 因长颈漏斗加热时容易破裂 | |
| D. | 尽量避免HC1挥发到空气中 |
14.下列说法中错误的是( )
| A. | 二氧化硫是非电解质 | |
| B. | 氢离子浓度相同的盐酸和醋酸导电能力相同 | |
| C. | 庆阳化铁胶体能导电,故氢氧化铁胶体是电解质 | |
| D. | 在相同温度下,饱和溶液不一定比不饱和溶液的导电性强 |
11.一定质量的某种有机物和足量金属钠反应,得到VA L气体,相同质量的该有机物与足量Na2CO3溶液反应,可得VB L气体,已知同温同压下VA≠VB.则该有机物可能是( )
| A. | CH3CH(OH)COOH | B. |  | ||
| C. | CH3CH2COOH | D. | HOOC-COOH |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加酚酞呈红色的溶液:I-,ClO-,NO3-,Na+ | |
| B. | 含有Fe3+的溶液:K+,Mg2+,SCN-,HSO3- | |
| C. | $\frac{Kw}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+,K+,SiO32-,Br- | |
| D. | 加Al能生成H2的溶液:Na+,K+,CO32-,Cl- |
8.H2和Cl2的混合气体a L点燃发生反应后,将气体通入含b mol NaOH的热溶液中,气体恰好与NaOH完全反应,生成NaCl,NaCIO和NaClO3.原混合气体中所含Cl2的物质的量为( )
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
15.下列实验操作正确的是( )
| A. | 将氯气溶于水,须通入倒置并边缘没入水中的漏斗 | |
| B. | 粉碎结块的硝酸铵,可将药品放入研体中轻轻敲碎 | |
| C. | 洗涤做过银镜反应的试管,先用浓硝酸洗涤,再用自来水冲洗 | |
| D. | 玻璃导管与橡皮导管连接,可使玻璃导管蘸水后边旋转边插入橡皮导管 |
19.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造更高价值化学品,例如:
CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+183.4kJ•mol-1
(1)已知该反应在一定条件下能自发进行,则下列说法正确的是②(填代号)
①该反应△S>0,反应条件为低温;
②该反应△S>0,反应条件为高温;
③该反应△S<0,反应条件为低温;
④该反应△S<0,反应条件为高温
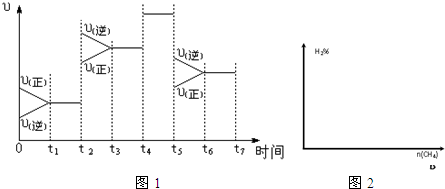
(2)如图1表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同).各阶段平衡时对应的平衡常数如表所示:
请判断K1、K2、K3、K4之间的关系为K1=K2=K3>K4.(用“>”、“<”或“=”连接).
(3)若该反应在某恒温恒容容器中进行,加入一定量的CO2,在图2中画出随起始CH4物质的量增加,平衡时H2百分含量的变化曲线.
(4)某温度下,向1L恒容密闭容器中通入1mol CO2、1mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α.
①3分钟内用氢气表示的化学反应速率为V(H2)=0.22mol•L-1•min-1,CO2转化率为α=0.33(结果均保留两位有效数字).
②其他条件不变,改为加入3mol CO2、3mol CH4,平衡时CO2的转化率会小于α.(填“大于”、“小于”、“等于”或“无法判断”)
③其他条件不变,如果起始时各物质的浓度如表
则从投料开始至达到平衡状态的反应过程中会放出(填“吸收”或“放出”)热量.
CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+183.4kJ•mol-1
(1)已知该反应在一定条件下能自发进行,则下列说法正确的是②(填代号)
①该反应△S>0,反应条件为低温;
②该反应△S>0,反应条件为高温;
③该反应△S<0,反应条件为低温;
④该反应△S<0,反应条件为高温
(2)如图1表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同).各阶段平衡时对应的平衡常数如表所示:
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
(3)若该反应在某恒温恒容容器中进行,加入一定量的CO2,在图2中画出随起始CH4物质的量增加,平衡时H2百分含量的变化曲线.

(4)某温度下,向1L恒容密闭容器中通入1mol CO2、1mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α.
①3分钟内用氢气表示的化学反应速率为V(H2)=0.22mol•L-1•min-1,CO2转化率为α=0.33(结果均保留两位有效数字).
②其他条件不变,改为加入3mol CO2、3mol CH4,平衡时CO2的转化率会小于α.(填“大于”、“小于”、“等于”或“无法判断”)
③其他条件不变,如果起始时各物质的浓度如表
| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |