题目内容
4.CO2和CO可以回收利用制取二甲醚、尿素、甲醇等.(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol.
(2)CO2合成尿素的反应为:CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)△H<0.该反应的平衡常数表达式为$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$.
(3)实验室模拟用CO和H2反应来制甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K值为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2(不必化简).
③若6min~8min只改变了某一条件,所改变的条件是加入1mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
分析 (1)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
根据盖斯定律,①×2+②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l),反应热也进行相应的计算;
(2)平衡常数是指生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比,纯液体或固体不需要写出;
(3)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式计算氢气的浓度变化量,2min时氢气浓度=4min时氢气浓度+氢气浓度变化量;
②4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,代入平衡浓度计算;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
④计算浓度商Qc,与平衡常数相比判断第8min时是否达到平衡状态;
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
解答 解:(1)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
根据盖斯定律,①×2+②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol,
故答案为:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol;
(2)CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)的平衡常数表达式K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$,
故答案为:$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$;
(3)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式可知氢气的浓度变化量为0.01mol/L×2=0.02mol/L,2min时氢气浓度=0.12mol/L+0.02mol/L=0.14mol/L,
故答案为:0.14;
②4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2,
故答案为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10L=1mol的氢气,
故答案为:加入1mol氢气;
④8min时浓度商Qc=$\frac{0.05}{0.05×0.{2}^{2}}$=25<K=$\frac{0.04}{0.06×0.1{2}^{2}}$=46.3,故8min时不是平衡状态,反应向正反应进行,
故答案为:不是;
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低,
故答案为:温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
点评 本题考查化学平衡计算及影响因素、平衡常数计算及应用、热化学方程式书写等,是对学生综合能力的考查,难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
| A. | 检验某稀溶液中是否含有NO3-,可先将溶液浓缩,然后加入浓H2SO4和铜片,观察有无红棕色气体产生 | |
| B. | 鉴别NO2和溴蒸气可用AgNO3溶液,也可用湿润的淀粉-KI试纸 | |
| C. | 除去NO中的NO2气体,可通入氧气 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再将湿润的红色石蕊试纸伸入试管,观察试纸是否变蓝 |
CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+183.4kJ•mol-1
(1)已知该反应在一定条件下能自发进行,则下列说法正确的是②(填代号)
①该反应△S>0,反应条件为低温;
②该反应△S>0,反应条件为高温;
③该反应△S<0,反应条件为低温;
④该反应△S<0,反应条件为高温
(2)如图1表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同).各阶段平衡时对应的平衡常数如表所示:
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
(3)若该反应在某恒温恒容容器中进行,加入一定量的CO2,在图2中画出随起始CH4物质的量增加,平衡时H2百分含量的变化曲线.
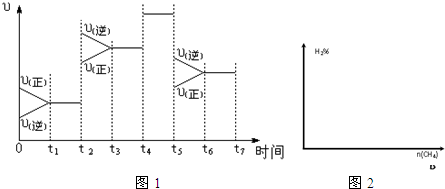
(4)某温度下,向1L恒容密闭容器中通入1mol CO2、1mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α.
①3分钟内用氢气表示的化学反应速率为V(H2)=0.22mol•L-1•min-1,CO2转化率为α=0.33(结果均保留两位有效数字).
②其他条件不变,改为加入3mol CO2、3mol CH4,平衡时CO2的转化率会小于α.(填“大于”、“小于”、“等于”或“无法判断”)
③其他条件不变,如果起始时各物质的浓度如表
| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |

填写下列空白:
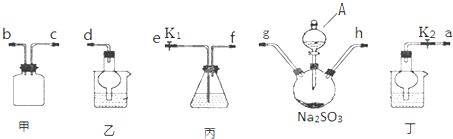
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式):
 .
.(2)试管C中苯的作用是除去溴化氢中混有的溴蒸汽;反应开始后,观察D试管,看到的现象为石蕊试液变红,并在导管中有白雾产生
(3)在上述整套装置中,具有防倒吸作用的仪器有DEF(填字母).
(4)反应完毕后,将a瓶中的液体取出,经过分液 (填分离操作的名称)可获得获得粗溴苯,向粗溴苯中加入无水CaCl2,其目的是干燥
(5)经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
①苯酚溶液加热变澄清
②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水
③苯酚可与FeCl3反应
④在苯酚溶液中加入浓溴水产生白色沉淀
⑤苯酚钠溶液中通入CO2,出现浑浊
⑥苯酚能与Na2CO3溶液反应放出CO2.
| A. | ②⑤ | B. | ⑤ | C. | ③④⑥ | D. | ③④⑤ |
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| B. | SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 | |
| C. | FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
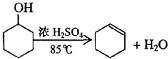
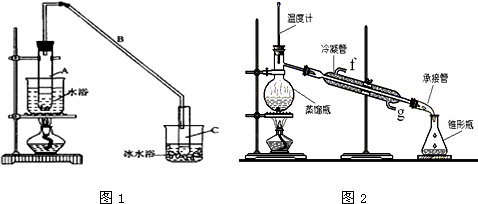
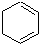 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程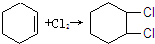 ;
; .
.