题目内容
7.下列物质性质与应用对应关系正确的是( )| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
分析 A、活泼金属采用电解其熔融盐的方法冶炼;
B、根据钠钾合金熔点低,可作原子反应堆的导热剂回答;
C、氧化铁为红棕色固体,氧化铁矿俗称赤铁矿;
D、溴易溶于四氯化碳,可用萃取的方法分离.
解答 解:A、镁是活泼金属,工业是采用电解熔融氯化镁的方法冶炼,故A错误;
B、钠钾合金熔点低,通常状况下呈液态,可作原子反应堆的导热剂,与硬度无关,故B错误;
C、Fe2O3是红棕色固体,可以制成红色的油漆、涂料,故C正确;
D、溴易溶于四氯化碳,可用萃取的方法分离溴水中的溴单质,不是溴离子,故D错误,故选C.
点评 本题主要考查的是金属的冶炼、合金的性质以及其用途、萃取等,综合性较强,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
9.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.下列有关说法正确的是( )
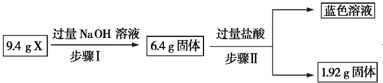

| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
18.下列说法正确的是( )
| A. | 按系统命名法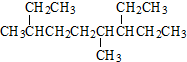 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 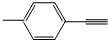 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇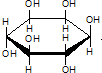 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol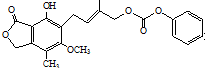 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
15.下列电离方程式中,正确的是( )
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
12.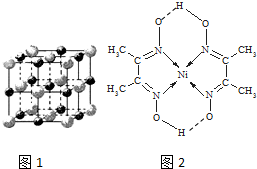 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键
(5)为消除温室效应的影响,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键
(5)为消除温室效应的影响,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
19.下列说法正确的是( )
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
16.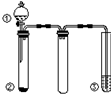 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
17. 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |