题目内容
4.下列事实、离子方程式及其对应关系均正确的是( )| A. | 向Ag2S浊液中滴加少量稀NaCl溶液,黑色沉淀逐渐变成白色:Ag2S+Cl-?AgCl+S2- | |
| B. | 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O | |
| D. | 向水杨酸(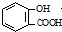 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: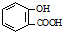 +2HCO3-→ +2HCO3-→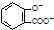 +2CO2↑+2H2O +2CO2↑+2H2O |
分析 A.AgCl的溶解度比Ag2S大,向AgCl悬浊液中滴加Na2S溶液,黑色沉淀不变;
B.K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加入酸,H+浓度增大,平衡左移;
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间发生氧化还原反应生成碘和水;
D.碳酸酸性强于酚,酚的酸性强于碳酸氢根离子,只有-COOH能与碳酸氢钠反应.
解答 解:A.AgCl的溶解度比Ag2S大,向AgCl悬浊液中滴加Na2S溶液,黑色沉淀不变,故A错误;
B.加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,溶液橙色加深或溶液颜色加深,故B错误;
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝的离子反应为4H++4I-+O2═2I2+2H2O,故C正确;
D.向水杨酸(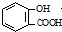 )中滴加NaHCO3溶液,的离子反应为
)中滴加NaHCO3溶液,的离子反应为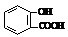 +HCO3-→
+HCO3-→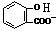 +CO2↑+H2O,故D错误;
+CO2↑+H2O,故D错误;
故选C.
点评 本题考查事实、离子方程式及其对应关系的判断,明确发生的化学反应是解答的关键,注意D碳酸酸性强于酚,酚的酸性强于碳酸氢根离子为解答的易错点,题目难度中等.

练习册系列答案
相关题目
6.下列有关说法正确的是( )
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |
15.下列电离方程式中,正确的是( )
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
12. (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
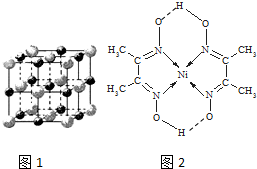
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键
(5)为消除温室效应的影响,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键
(5)为消除温室效应的影响,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
19.下列说法正确的是( )
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
9.X、Y、Z、W的原子序数依次增大的短周期元素,其含氧酸根离子不能破坏水的电离平衡的是( )
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |
16.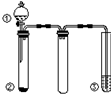 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关说法正确的是( )
| A. | 反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应的△H<0 | |
| B. | 铅蓄电池放电时反应为:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、负极质量均减小 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,充分搅拌后过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
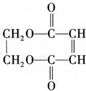 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: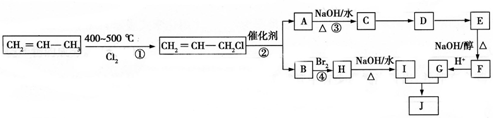
 ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).