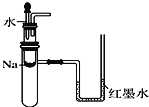
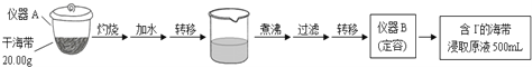
��Ŀ����
����Ŀ���о����ʵ��۽ṹ�������������������ʱ仯�ı��ʡ�
��1��N��Al��Si��Zn����Ԫ���У���һ��Ԫ�صĵ������������£�
������ | I1 | I2 | I3 | I4 | I5 | ���� |
Im/kJ��mol��1 | 578 | 1817 | 2745 | 11575 | 14830 | ���� |
���Ԫ����______(��Ԫ�ط���)��
��2����Ԫ�ؿ����γ������������������������й㷺��Ӧ�á�
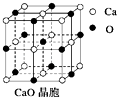
��ά����B4�ṹ��ͼ��ʾ����̼ԭ�ӵĹ���ӻ�������_________��1 molά����B4�����к��ЦҼ�����ĿΪ________��
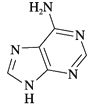
��NF3�Ŀռ乹��Ϊ______(����������)����NF3���ӻ�Ϊ�ȵ������������Ϊ______(�ѧʽ)��
��3������Ԫ�س���H2O��NH3��CN����SCN�����γ�����
��C��N��O����Ԫ�صĵ縺���ɴ�С��˳��Ϊ________��
��X��Y��Ϊ��������Ԫ�ء�X��̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ1��Y��̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬��X����̬��������Ų�ʽ________��Ԫ��Y�����ڱ���λ�ڵ�________�塣
����������[Fe(SCN)]2+�У��ṩ�չ������________��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ________��
���𰸡� Al sp2 16 mol ������ SO![]() ��ClO O��N��C 1s22s22p63s23p63d10 �� [Ar]3d10 ��B Fe3+
��ClO O��N��C 1s22s22p63s23p63d10 �� [Ar]3d10 ��B Fe3+ 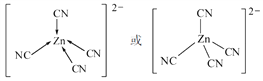
����������1������Ԫ�ص�����֪�����������ܺ͵��ĵ��������ϴ�˵����Ԫ��ԭ��ʧȥ3������ʱ��Ϊ�ȶ��ṹ���������Ԫ��ԭ���������3�����ӣ�N��Al��Si��Zn����Ԫ�ص�ԭ����ֻ��Alԭ���������3�����ӣ����Ԫ����Al����2����ά����B4�ṹ��ͼ��ʾ����̼ԭ�Ӿ��γ�һ��˫��������ӻ�������sp2��˫������1���Ҽ���1��![]() ��������1 molά����B4�����к��ЦҼ�����ĿΪ16 mol����NF3��Nԭ�ӵļ۲���Ӷ���=3+
��������1 molά����B4�����к��ЦҼ�����ĿΪ16 mol����NF3��Nԭ�ӵļ۲���Ӷ���=3+![]() =4����һ���µ��Ӷԣ����Է��ӵĿռ乹���������Σ�ͬ����Ԫ�ؼ۵�������ͬ������NF3���ӻ�Ϊ�ȵ������������ΪSO
=4����һ���µ��Ӷԣ����Է��ӵĿռ乹���������Σ�ͬ����Ԫ�ؼ۵�������ͬ������NF3���ӻ�Ϊ�ȵ������������ΪSO![]() ��ClO����3����Ԫ��ԭ�ӵĵõ�������Խǿ����縺��Խ������O>N>C����Ԫ��X λ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ����ڲ������=2+8+18=28��������������Ϊ1�����Ը�ԭ����29�����ӣ�ΪCuԪ�أ�Ԫ��YΪ��������Ԫ�أ���̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬�����Ų�ʽΪ3d54s1����Y��CrԪ�أ���X����̬��������Ų�ʽ1s22s22p63s23p63d10 �� [Ar]3d10��Ԫ��Y��Cr,�����ڱ���λ�ڵڢ�B�壻����������[Fe(SCN)]2+�У�����������ṩ�µ��Ӷԣ����������������ṩ�չ�����ʴ�Ϊ��Fe3+��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ
��ClO����3����Ԫ��ԭ�ӵĵõ�������Խǿ����縺��Խ������O>N>C����Ԫ��X λ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ����ڲ������=2+8+18=28��������������Ϊ1�����Ը�ԭ����29�����ӣ�ΪCuԪ�أ�Ԫ��YΪ��������Ԫ�أ���̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬�����Ų�ʽΪ3d54s1����Y��CrԪ�أ���X����̬��������Ų�ʽ1s22s22p63s23p63d10 �� [Ar]3d10��Ԫ��Y��Cr,�����ڱ���λ�ڵڢ�B�壻����������[Fe(SCN)]2+�У�����������ṩ�µ��Ӷԣ����������������ṩ�չ�����ʴ�Ϊ��Fe3+��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ ��
��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�