题目内容
【题目】按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④CaF2晶体⑤P4O10晶体⑥碳化硅晶体.其中属于离子晶体的是 , 属于分子晶体的是 , 属于原子晶体的是 .
(2)有下列分子:HCN、P4、SO2、PCl3、BF3 , 其中属于非极性分子的是 .
(3)有下列离子:SO32﹣、SO42﹣、CO32﹣ , 其中空间构型为正四面体形的是 , 中心原子的杂化轨道类型属于sp2杂化的是 .
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为;与每一个钙离子距离最近并且距离相等的钙离子有个.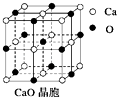
【答案】
(1)③④,①⑤,②⑥
(2)P4、BF3
(3)SO42﹣,CO32﹣
(4)6,12
【解析】解:(1)①碳60(C60)晶体是由分子构成,为分子晶体;
②硼晶体是由原子构成空间网状态结构的晶体,为原子晶体;
③Na2O晶体是阴、阳离子构成的离子晶体;
④CaF2晶体是由钙离子和氟离子构成的,为离子晶体;
⑤P4O6晶体是由P4O6分子构成的,为分子晶体;
⑥碳化硅晶体是由碳原子和硅原子构成的,且原子之间是通过共价键作用,为原子晶体;
所以属于离子晶体的是③④;属于分子晶体的是①⑤,属于原子晶体的是②⑥,
所以答案是:③④;①⑤;②⑥;
(2)HCN分子中分子不对称,电荷分布不均匀,为极性分子;P4分子中P﹣P键为非极性键,所以分子为非极性分子;SO2中S元素化合价为+4,S原子最外层6个电子部成键,为极性分子;PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
所以答案是:P4、BF3;
(3)SO32﹣中S原子的价层电子对为 ![]() =4,VSEPR模型为正四面体,中心原子的杂化方式为sp3杂化,SO42﹣S原子的价层电子对为
=4,VSEPR模型为正四面体,中心原子的杂化方式为sp3杂化,SO42﹣S原子的价层电子对为 ![]() =4,VSEPR模型为正四面体,中心原子的杂化方式为sp3杂化,空间构型为正四面体形;CO32﹣中C原子的价层电子对为
=4,VSEPR模型为正四面体,中心原子的杂化方式为sp3杂化,空间构型为正四面体形;CO32﹣中C原子的价层电子对为 ![]() =3,VSEPR模型为平面三角形,中心原子的杂化方式为sp2杂化,
=3,VSEPR模型为平面三角形,中心原子的杂化方式为sp2杂化,
所以答案是:SO42﹣;CO32﹣;
(4)由CaO晶胞结构可知,CaO晶体中每个O2﹣的周围有6个Ca2+,每个Ca2+的周围有6个O2﹣,与每一个钙离子距离最近并且距离相等的钙离子是x、y、z平面上各有4个,
所以答案是:6;12.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | I5 | …… |
Im/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | 14830 | …… |
则该元素是______(填元素符号)。
(2)氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
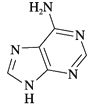
①维生素B4结构如图所示,则碳原子的轨道杂化类型是_________;1 mol维生素B4分子中含有σ键的数目为________。
②NF3的空间构型为______(用文字描述);与NF3分子互为等电子体的阴离子为______(填化学式)。
(3)过渡元素常与H2O、NH3、CN-、SCN-等形成配合物。
①C、N、O三种元素的电负性由大到小的顺序为________。
②X、Y均为第四周期元素。X基态原子的内层轨道全部排满电子,且最外层电子数为1。Y基态原子在同周期元素中未成对电子数最多,则X+基态核外电子排布式________;元素Y在周期表中位于第________族。
③在配离子[Fe(SCN)]2+中,提供空轨道的是________;[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,则[Zn(CN)4]2-的结构可用示意图表示为________。