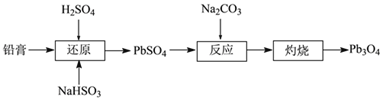
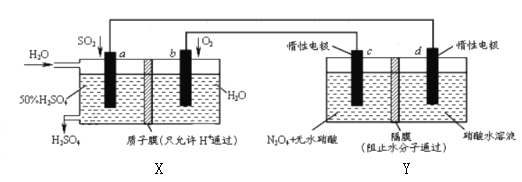
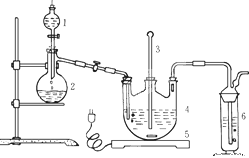
题目内容
【题目】在迎接“绿色校园”的主题活动中,小明同学提出下列倡议,不可采纳的是( )
A.提倡绿色出行
B.提倡使用无磷洗涤剂
C.提倡使用一次性塑料袋
D.提倡垃圾分类和回收利用
【答案】C
【解析】A、绿色出行指的是步行、骑车或是选择公共交通工具,能降低能源的消耗,减少环境污染,故A不符合题意;
B、含大量磷元素的污水能引起水体富营养化,所以开发无磷洗涤剂,能防止水体污染,故B不符合题意;
C、一次性发泡塑料餐具和塑料袋废弃物在自然界中难降解,所以使用一次性发泡塑料餐具和塑料袋会引起白色污染,故C符合题意;
D、垃圾分类有利于回收利用,能变废为宝,故D不符合题意.
故答案为:C
根据绿色化学的理念进行判断是否符合绿色化学即可。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | I5 | …… |
Im/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | 14830 | …… |
则该元素是______(填元素符号)。
(2)氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
①维生素B4结构如图所示,则碳原子的轨道杂化类型是_________;1 mol维生素B4分子中含有σ键的数目为________。
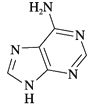
②NF3的空间构型为______(用文字描述);与NF3分子互为等电子体的阴离子为______(填化学式)。
(3)过渡元素常与H2O、NH3、CN-、SCN-等形成配合物。
①C、N、O三种元素的电负性由大到小的顺序为________。
②X、Y均为第四周期元素。X基态原子的内层轨道全部排满电子,且最外层电子数为1。Y基态原子在同周期元素中未成对电子数最多,则X+基态核外电子排布式________;元素Y在周期表中位于第________族。
③在配离子[Fe(SCN)]2+中,提供空轨道的是________;[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,则[Zn(CN)4]2-的结构可用示意图表示为________。