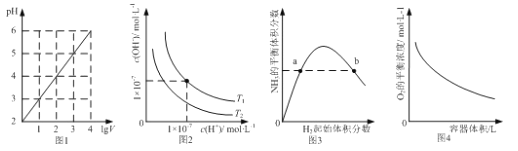
题目内容
【题目】美国医学家证实了三价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的价层电子排布式为__________________。
(2)O、N、S、Cr的第一电离能由大到小的顺序为___________________。
(3)SO2分子的VSEPR模型的名称为_________,SO32-离子中心原子的杂化方式为_________。
(4)CO2分子立体构型的名称为_________,它的等电子体中属于分子的有_________(任写一种)。
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·H2O,该物质配离子中提供孤电子对的原子为_________,配位数为_________。
(6)NH3分子可以与H+结合生成NH4+,这个过程发生改变的是_________(填序号)。
a.微粒的空间构型 b.N原子的杂化类型 c.H-N-H的键角 d.微粒的电子数
(7)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为pg/cm3,则该晶胞的棱长为_________pm。

【答案】 3d54s1 N>O>S>Cr 平面三角 sp3杂化 直线形 N2O O、Cl 6 a、c a=![]() ×1010pm
×1010pm
【解析】(1)Cr元素为24号元素,原子核外有24个电子,其电子排布式为:1s22s22p63s23p63s23p63d54s1,所以Cr原子的价电子排布式是3d54s1;
(2)C、N、O属于同一周期元素,同一周期元素的第一电离能随着原子序数的增大而增大,但N原子2p能级为半充满稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以第一电离能大小顺序N>O>C;同主族由上到下元素原子的第一电离能逐渐减小,O、S元素的第一电离能O>S;Cr为金属元素,较易失去电子,第一电离能较小,故四种元素第一电离能的大小顺序为:N>O>S>Cr;
(3)中心原子S提供6个电子,O不提供,共3对电子,3个轨道,所以其VSEPR模型为平面三角形;SO32-中S原子价层电子对个数是4,且含有一个孤电子对,所以S原子采用sp3杂化,故答案为:平面三角;sp3杂化;
(4)CO2的价层电子对个数=2+(4-2×2)÷2=2,该分子是直线形结构;具有相同原子数和价电子数的分子或离子叫等电子体,CO2分子中都含有3个原子,16个价电子,N2O与CO2为等电子体。故答案为:直线形;N2O;
(5)配离子为[Cr(H2O)4Cl2]+,配体为H2O、Cl-,提供孤对电子的原子为O和Cl,Cr的配位数为6,故答案为:O、Cl;6 ;
(6)NH3分子是三角锥型,NH4+是正四面体型,空间构型不同,且键角不同,故a、c正确;NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;NH4+中N原子成4个N-H键,杂化轨道数目为4,采取sp3杂化,故N原子的杂化类型相同,b错误;NH3和NH4+都含有10个电子,故d错误。故选a、c。
(7)根据均摊数可知,晶胞中含有碳原子数为![]() =8,该晶胞的质量为m=
=8,该晶胞的质量为m= ![]() ;该晶胞的体积V=
;该晶胞的体积V= 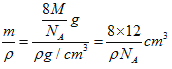 ;所以,该晶胞的棱长=
;所以,该晶胞的棱长=  。
。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | I5 | …… |
Im/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | 14830 | …… |
则该元素是______(填元素符号)。
(2)氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
①维生素B4结构如图所示,则碳原子的轨道杂化类型是_________;1 mol维生素B4分子中含有σ键的数目为________。
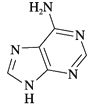
②NF3的空间构型为______(用文字描述);与NF3分子互为等电子体的阴离子为______(填化学式)。
(3)过渡元素常与H2O、NH3、CN-、SCN-等形成配合物。
①C、N、O三种元素的电负性由大到小的顺序为________。
②X、Y均为第四周期元素。X基态原子的内层轨道全部排满电子,且最外层电子数为1。Y基态原子在同周期元素中未成对电子数最多,则X+基态核外电子排布式________;元素Y在周期表中位于第________族。
③在配离子[Fe(SCN)]2+中,提供空轨道的是________;[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,则[Zn(CN)4]2-的结构可用示意图表示为________。