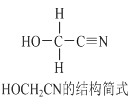
题目内容
【题目】下列实验操作无不当之处的是( )
A.用稀硫酸和锌粒制取![]() 时,加几滴
时,加几滴![]() 溶液以加快反应速率
溶液以加快反应速率
B.用蒸馏水润湿的pH试纸测某气体的酸碱性
C.淀粉水解实验中可加银氨溶液并水浴加热检验淀粉的水解产物葡萄糖
D.在50mL酸式滴定管中装入盐酸,调整初始读数为![]() 后,将剩余盐酸放入锥形瓶,可以量出
后,将剩余盐酸放入锥形瓶,可以量出![]() 的盐酸
的盐酸
【答案】B
【解析】
A.加几滴![]() 溶液,不能构成原电池;
溶液,不能构成原电池;
B.蒸馏水润湿的pH试纸测某气体的酸碱性,气体与水反应生成酸或碱;
C.水解后检验葡萄糖在碱性条件下;
D.剩余盐酸放入锥形瓶,滴定管下方无刻度。
![]() 加几滴
加几滴![]() 溶液,Zn不能置换Mg,不能构成原电池加快生成氢气的反应速率,故A不选;
溶液,Zn不能置换Mg,不能构成原电池加快生成氢气的反应速率,故A不选;
B.蒸馏水润湿的pH试纸测某气体的酸碱性,气体与水反应生成酸或碱,可检验气体,故B选;
C.水解后检验葡萄糖在碱性条件下,再加银氨溶液并水浴加热,故C不选;
D.剩余盐酸放入锥形瓶,滴定管下方无刻度,则剩余盐酸的体积大于![]() ,故D不选;
,故D不选;
故选:B。

【题目】50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液在图 1 装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)写出该反应的中和热热化学方程式:___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(“增加”、“减少”或“不变”),所求中和热数值_____(“增加”、“减少”或“不变”)。
(4)某研究小组将装置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知浓度的 NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图 2 所示(实验中始终保持 V1+V2 = 50mL)。回答下列问题:研究小组做该实验时环境温度_________(填“高于”、“低于”或“等于”)22℃。
(5)①请填写下表中的空白:
温度 实验次数 | 起始温度 t1℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似认为 50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液的密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃)。则中和热Δ H=_________( 取小数点后一位)。