题目内容
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
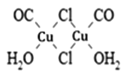
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
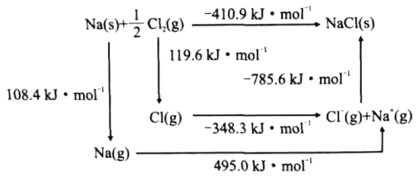
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:
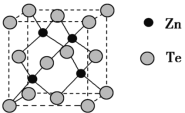
若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
【答案】第四周期Ⅷ Co失去的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需要的能量较高 sp3 电负性C<O,C对孤电子对的吸引力较弱,更容易给出孤电子对 cd 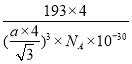
【解析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置。根据原子及其离子的价电子排布分析其电离能的相对大小。根据价层电子对互斥理论分析原子的杂化类型。根据电负性的大小分析配合物中的配位原子。分析表中数据并结合相关概念判断有关变化中能量变化。根据晶胞结构分析晶体的化学式并进行相关计算。
(1)钴是27号元素,其有4个电子层,其价电子排布式为3d74s2,因此,其在周期表中的位置是第四周期Ⅷ族。
(2)Fe的价电子排布式为3d64s2,其失去3个电子后变为较稳定的半充满结构3d5,而Co的价电子排布式为3d74s2,其失去3个电子后变为3d6。因此,从原子结构的角度分析I4(Fe)> I4 (Co)的可能原因是:Co失去的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需要的能量较高。
(3)由Cu2Cl22CO2H2O的结构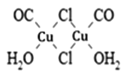 可知:
可知:
①该配合物中氯原子均形成2个σ键,另外每个氯原子还有2个孤电子对,故其价层电子对数为4,其杂化方式为sp3。
②CO分子中的C原子和O原子均有孤电子对,但是O元素的电负性大于C元素,故O原子对孤电子对的吸引力更强,因此,该配合物中,CO作配体时配位原子是C而不是O的原因是:电负性C<O,C对孤电子对的吸引力较弱,更容易给出孤电子对(用于形成配位键)。
(4)a、由图中信息可知,![]() Cl2(g)=Cl(g)的H=119.6kJ/mol,因此, Cl-Cl键的键能为239.2kJ/mol ,a不正确;
Cl2(g)=Cl(g)的H=119.6kJ/mol,因此, Cl-Cl键的键能为239.2kJ/mol ,a不正确;
b、由图中信息可知,Na(g)=Na+(g)+e-的H=495.0kJ/mol,因此, Na的第一电离能为603.4kJ/mol,b不正确;
c、由图中信息可知,Cl-(g)+ Na+(g)= NaCl(s)的H= -785kJ/mol,因此,NaCl的晶格能为785.6kJ/mol,c正确;
d、由图中信息可知,Cl(g) +e-=Cl-(g) 的H= -348.3kJ/mol,因此,Cl的第一电子亲和能为348.3kJ/mol,d正确。
综上所述,有关说法正确的是cd。
(5)由碲化锌晶体的晶胞结构示意图可知,其晶胞结构与金刚石相似,Te原子堆积方式为面心立方最密堆积,Zn距离最近的Te原子间距为体对角线长度的![]() ,高晶胞参数(即该晶胞的边长)为x,则晶胞的体对角线长度为,
,高晶胞参数(即该晶胞的边长)为x,则晶胞的体对角线长度为,![]() x=4a pm,故x=
x=4a pm,故x=![]() pm,晶胞的体积为x3=
pm,晶胞的体积为x3=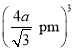 。该晶胞中占有4个Te原子和4个Zn原子,则晶胞的质量为
。该晶胞中占有4个Te原子和4个Zn原子,则晶胞的质量为![]() 。因此,该晶体密度为
。因此,该晶体密度为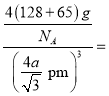
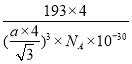 g/cm3。
g/cm3。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案