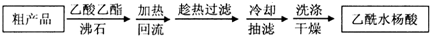题目内容
16.1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2$\stackrel{催化剂}{?}$2NH3,有关说法正确的是( )| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
分析 A.不同的催化剂催化机理不同,效果也不同;
B.高温条件需要大量能源;
C.化学反应的实质是旧化学键的断裂和新化学键的形成;
D.两个化学反应都是放热反应.
解答 解:A.不同的催化剂催化机理不同,效果也不同,但在其他条件相同时,转化率是一样的,故A错误;
B.高温条件需要大量能源,用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,减少能源消耗,所以新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景,故B正确;
C.新法实际上是降低了反应所需的能量,旧化学键要断裂、新化学键也同时生成,反应的本质与催化剂无关,故C错误;
D.新法合成与哈伯法合成都是反应物总能量大于生成物总能量,所以都是放热反应,只是新法降低了反应所需的能量,减少能源消耗,故D错误;
故选B.
点评 本题考查催化剂对化学反应的影响,催化剂能通过改变活化能而影响反应速率,但不影响平衡移动,为易错题.

练习册系列答案
相关题目
6.下列装置或操作能达到实验目的是( )
| A. | 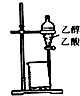 除去乙醇中的乙酸 | B. | 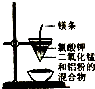 制取少量金属锰 | ||
| C. | 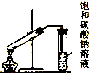 制取乙酸乙酯 | D. |  证明酸性:盐酸>碳酸>硅酸 |
7.在标准状况下,在三个干燥的烧瓶内分别装入:纯净的NH3,含有少量空气的NH3,NO2和O2的混合气体[v(NO2):v(O2)=4:1].然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
4.下列仪器的使用或操作或实验正确的是( )
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
11.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | |
| B. | A与C可形成离子化合物 | |
| C. | A的氧化物熔点比B的氧化物高 | |
| D. | B单质可与A的最高价氧化物发生置换反应 |
5.下列物质间的反应能用H++OH-═H2O表示的是( )
| A. | 醋酸和氢氧化钠 | B. | 盐酸和氨水 | ||
| C. | 硫酸和氢氧化钾 | D. | 碳酸氢钠和氢氧化钠 |
6.根据下面的信息,下列叙述不正确的是( )


| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
 (1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略). .
.