题目内容
6.根据下面的信息,下列叙述不正确的是( )
| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
分析 A.依据信息中化学键的断裂吸收的能量和形成化学键放出的热量分析判断;
B.依据化学键的键能以及可逆反应的热效应相反分析判断;
C.依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断;注意物质的聚集状态;
D.依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断.
解答 解:反应的焓变=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ,所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,
A.化学键的断裂吸收的能量和形成化学键放出的热量是化学反应中发生能量变化的主要原因,故A正确;
B.根据以上计算可知,氢气与氧气反应生成水是放热反应,所以水分解生成氢气跟氧气的同时吸收能量,故B正确;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,故C错误;
D.依据反应的热化学方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,可知同乘以2得到2H2(g)+O2(g)=2H2O(g)△H=-490KJ/mol,即:2molH2(g)跟1mol O2(g)反应生成2mol H2O(g)释放能量490kJ,故D正确;
故选C.
点评 本题考查了反应的热效应的计算依据和判断方法,题目难度中等,注意明确旧键断裂吸热热量,新键形成放出热量,要求学生能够依据化学键的键能来计算判断吸热反应和放热反应,即:反应的热效应=反应物的键能之和-生成物的键能之和.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
16.1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2$\stackrel{催化剂}{?}$2NH3,有关说法正确的是( )
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
14.如图为某原电池的示意图,下列说法正确的是( )
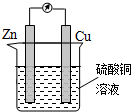

| A. | 铜片作负极 | B. | 溶液的颜色逐渐变浅 | ||
| C. | 电子由铜棒流出 | D. | 锌片上发生还原反应 |
1.现有X、Y、Z、W四种无色溶液,分别是HCl、Ba(NO3)2、Na2CO3、AgNO3中的一种.两两之间相互反应的现象(沉淀↓、气体↑)如表所示:试判断溶液X、Y、Z、W依次是( )
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
18.下列各种方法中,适用于炼制相应金属的是( )
| A. | 加热氧化铜炼铜 | B. | 氧化镁跟铝粉共热炼镁 | ||
| C. | 用焦炭还原氧化铜炼铜 | D. | 电解熔融氯化钠冶炼钠 |
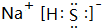 .
.