题目内容
5.下列物质间的反应能用H++OH-═H2O表示的是( )| A. | 醋酸和氢氧化钠 | B. | 盐酸和氨水 | ||
| C. | 硫酸和氢氧化钾 | D. | 碳酸氢钠和氢氧化钠 |
分析 离子方程式H++OH-═H2O表示强酸和强碱反应生成可溶性的盐和水的一类反应,据此进行判断.
解答 解:A.醋酸属于弱酸,应该写成分子式,反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能用H++OH-═H2O表示,故A错误;
B.盐酸和氯化氢反应生成了铵离子和水,反应的离子方程式为:NH3•H2O+H+═NH4++H2O,不能够用离子方程式H++OH-=H2O表示,故B错误;
C.氢氧化钾是强碱、硫酸是强酸,生成的硫酸钠是易溶于水的盐,能用H++OH-═H2O表示,故C正确;
D.碳酸氢钠和氢氧化钠反应的离子反应为:HCO3-+OH-=H2O+CO32-,所以碳酸氢钠和氢氧化钠的反应不能用H++OH-═H2O表示,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高考常见题型,题目难度中等,侧重学生思维严密性的考查,注意把握反应实质及离子反应的书写方法.

练习册系列答案
相关题目
15.已知外电路中,电子由铜流向a极.有关图所示的装置分析合理一项是( )
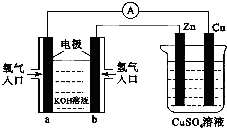

| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L | |
| C. | b极反应的电极反应式为:H2-2e-═2H+ | |
| D. | 一段时间后锌片质量减少 |
16.1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2$\stackrel{催化剂}{?}$2NH3,有关说法正确的是( )
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
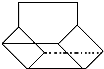
13.乙炔在不同条件下可以转化成许多化合物(如图),下列叙述错误的是( )
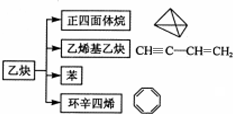

| A. | 图中五种有机物的实验式相同 | |
| B. | 乙炔生成乙烯基乙炔是加成反应 | |
| C. | 等质量的苯与乙烯基乙炔完全燃烧的耗氧量不同 | |
| D. |  与环辛四烯均能使溴水褪色 与环辛四烯均能使溴水褪色 |
14.如图为某原电池的示意图,下列说法正确的是( )
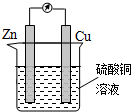

| A. | 铜片作负极 | B. | 溶液的颜色逐渐变浅 | ||
| C. | 电子由铜棒流出 | D. | 锌片上发生还原反应 |
18.下列各种方法中,适用于炼制相应金属的是( )
| A. | 加热氧化铜炼铜 | B. | 氧化镁跟铝粉共热炼镁 | ||
| C. | 用焦炭还原氧化铜炼铜 | D. | 电解熔融氯化钠冶炼钠 |

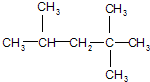 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简 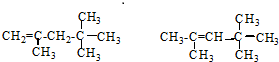 .
.
 .
.