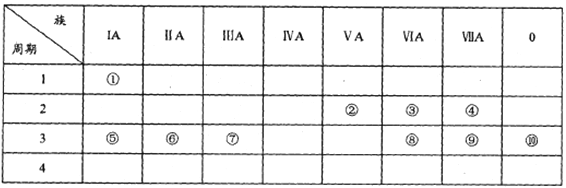
��Ŀ����
����Ŀ����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����
2NH3(g)��CO2(g)�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����
A. 2v(NH3) �� v(CO2)
B. �ܱ���������ѹǿ����
C. �ܱ������л�������ƽ��Ħ����������
D. �ܱ������ж�����̼�������������
���𰸡�B
��������A. 2v(NH3) �� v(CO2)δ��������Ĺ�ϵ����A����B. �ܱ���������ѹǿ���䣬˵�������ʵ������䣬���淴Ӧ������ȣ���B��ȷ��C. ��Ϊ��Ӧ���ǹ��壬���������ܱ������л�������ƽ��Ħ�������Ǹ���ֵ��ʼ�ղ��䣬��C����D. ��Ϊ��Ӧ���ǹ��壬�����а����Ͷ�����̼�����ʵ���֮��Ϊ2:1��������������������䣬��D������������������ӦѡB��

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�����Ŀ��һ���¶�ʱ����2.0L�����ܱ������г���2mol SO2��1mol O2 �� ������Ӧ�� 2SO2��g��+O2��g��2SO3��g��������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | t1 | t2 | t3 | t4 |
n��SO3��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
����˵����ȷ���ǣ� ��
A.��Ӧ��ǰt1 s ��ƽ������v��O2��= ![]() ?mol?L��1?s��1
?mol?L��1?s��1
B.���������������䣬���ѹ����1.0L��ƽ�ⳣ��������
C.��ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �ﵽƽ��ʱ��SO3��ת���ʴ���10%
D.�����¶Ȳ��䣬����������ٳ���2mol SO2��1mol O2 �� ��Ӧ�ﵽ��ƽ��ʱ ![]() ����
����