��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣��û�ѧ����ش���������:
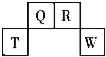
��1���뻭��Ԫ���������ӵĽṹʾ��ͼ:________��
��2���ۢݢ���ԭ�Ӱ뾶��С�����˳��Ϊ________(��Ԫ�ط���)��
��3��������������������Ӧˮ����ļ���ǿ��Ϊ_____>____(�ѧʽ)��
��4���ۢ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ_______��
��5���õ���ʽ��ʾ�������γɵĻ�����Ĺ���:_________��
II.�ɱ�����~���е�һ�ֻ���Ԫ���γɵij�������A��B��C�ɷ������·�Ӧ(����������ȥ)����ش���������:
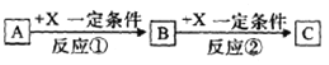
��1����X��һ�ֳ������ɽ������ʣ���C��ˮ��Һ�еμ�AgNO3��Һ������������ϡ����İ�ɫ�����������C��Һ�н������ӵķ�����_______����֪��������Һ�иý��������ܱ�˫��ˮ������д���÷�Ӧ�����ӷ���ʽ:___________��
��2����A��B��CΪ����ͬһ����Ԫ�ص��������XΪǿ�A��Һ��C��Һ��Ӧ����B����B�Ļ�ѧʽΪ___________��
���𰸡� 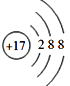 O<S<Na NaOH Al(OH)3 Na��[
O<S<Na NaOH Al(OH)3 Na��[![]()
![]() ]2��Na��
]2��Na�� ![]() �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ�� H2O2+2Fe2++2H+===2Fe3++2H2O Al(OH)3
�ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ�� H2O2+2Fe2++2H+===2Fe3++2H2O Al(OH)3
����������.����Ԫ���������ڱ��е�λ��������֪��Ԫ�طֱ�Ϊ����ΪHԪ��, ��ΪNԪ��, ��ΪOԪ��, ��ΪFԪ��, �� ΪNaԪ��, ��ΪMgԪ��,��ΪAlԪ��, ��ΪSԪ��, ��Ϊ Cl Ԫ������ ΪArԪ����
��1��Ԫ�آ�ΪCl��![]() ����������Ϊ17�����������Ϊ18����3�����Ӳ������������Ϊ2��8��8,�������ӵĽṹʾ��ͼΪ��
����������Ϊ17�����������Ϊ18����3�����Ӳ������������Ϊ2��8��8,�������ӵĽṹʾ��ͼΪ��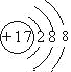 ����ȷ��:
����ȷ��: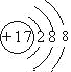 ��
��
��2����ΪOԪ������ ΪNaԪ������ΪSԪ����ͬ����Ԫ�ش�����ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����������ԭ�Ӱ뾶��С����ΪO<S<Na����ȷ��: O<S<Na ��
��3���� ΪNaԪ��, ��ΪAlԪ�����ݺ͢ߵ�����������Ӧˮ����ΪNaOH�� Al(OH)3 ��Ԫ�صĽ�����Խǿ������������Ӧˮ������Ծ�Խǿ����˼���NaOH >_ Al(OH)3 ����ȷ�𰸣�>��
��4���� ΪNaԪ��, ��ΪOԪ��, �ۢ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������Ϊ�������ƣ�������Ϊ���ӻ��������ʽΪ ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��5����ΪMgԪ��, ��Ϊ Cl Ԫ�أ��Ȼ�þΪ���ӻ�����γɹ������е��ӵ�ʧ���õ���ʽ��ʾ�γɵĻ�����Ĺ���: ![]() ����ȷ����
����ȷ����![]() ��
��
II. ��1����C��ˮ��Һ�еμ�![]() ��Һ������������ϡ
��Һ������������ϡ![]() �İ�ɫ������C�к���ClԪ����X��һ�ֳ������ɽ�����������AΪ������BΪ�Ȼ�����CΪ�Ȼ���������C�е�������Ϊ���������������Լ�KSCN��Һ����ˮ������������Ϊ:�ȵμ�KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ(����NaOH��Һ���Ȳ�����ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ)����������Һ�����������ܱ�˫��ˮ���������ӷ�ӦΪH2O2+2Fe2++2H+===2Fe3++2H2O����ȷ��: �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ���� H2O2+2Fe2++2H+===2Fe3++2H2O ��
�İ�ɫ������C�к���ClԪ����X��һ�ֳ������ɽ�����������AΪ������BΪ�Ȼ�����CΪ�Ȼ���������C�е�������Ϊ���������������Լ�KSCN��Һ����ˮ������������Ϊ:�ȵμ�KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ(����NaOH��Һ���Ȳ�����ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ)����������Һ�����������ܱ�˫��ˮ���������ӷ�ӦΪH2O2+2Fe2++2H+===2Fe3++2H2O����ȷ��: �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ���� H2O2+2Fe2++2H+===2Fe3++2H2O ��
��2����A��B��CΪ����ͬһ����Ԫ�ص�����������XΪǿ�������A��Һ��C��Һ��Ӧ����![]() ��CΪƫ����������A��C��Ӧ�����ӷ�ӦΪ
��CΪƫ����������A��C��Ӧ�����ӷ�ӦΪ![]() �T
�T![]() ��,��ȷ��Al(OH)3��
��,��ȷ��Al(OH)3��