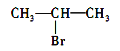题目内容
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③B. ①②④C. ③④⑤D. ①②③④
【答案】A
【解析】
根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,可用sp2杂化轨道来解释说明中心原子含有3个价层电子对,据此判断杂化类型。
①BF3分子中硼原子杂化轨道数为3,所以采取sp2杂化,故正确;
②CH2=CH2分子中每个碳原子杂化轨道数为3,所以采取sp2杂化,故正确;
③![]() 6分子中碳原子杂化轨道数为3,所以采取sp2杂化,故正确;
6分子中碳原子杂化轨道数为3,所以采取sp2杂化,故正确;
④CH≡CH分子中每个碳原子杂化轨道数为2,所以采取sp杂化,故错误;
⑤NH3分子中氮原子杂化轨道数为4,所以采取sp3杂化,故错误;
⑥CH4分子中碳原子杂化轨道数为4,所以采取sp3杂化,故错误;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目