题目内容
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
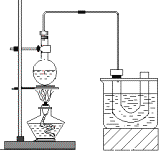
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇(密度为0.789g/cm3)、28mL78%浓硫酸,然后加入研细的23g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式___________________________________。
(2)在大烧杯加入冰水的作用是____________________________________。溴乙烷的水溶性小于乙醇的水溶性,其原因是_________________________。反应一段时间后,U型管内可观察到的现象是___________________________。
(3)反应时若温度过高会有副反应发生,写出发生有机副反应的化学方程式________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,最好选择下列试剂中的__________(填序号)
A.H2O B.CCl4 C.Na2SO3溶液 D.NaOH溶液
除杂所需的主要玻璃仪器是__________________(填仪器名称)。要进一步制得纯净的溴乙烷,可再用水洗,然后加入无水CaCl2,再进行_________________(填操作名称)。
(5)最后制得溴乙烷产品14.2g,求上述实验中溴乙烷的产率为____________
【答案】CH3CH2OH+HBr ![]() CH3CH2Br+H2O 冷却生成的溴乙烷,防止生成的溴乙烷挥发 乙醇可与H2O分子间形成氢键,而溴乙烷不能 有油状液体生成 CH3CH2OH
CH3CH2Br+H2O 冷却生成的溴乙烷,防止生成的溴乙烷挥发 乙醇可与H2O分子间形成氢键,而溴乙烷不能 有油状液体生成 CH3CH2OH ![]() CH2=CH2+H2O或2CH3CH2OH
CH2=CH2+H2O或2CH3CH2OH![]() CH3CH2OCH2CH3+H2O C 分液漏斗 蒸馏 80%
CH3CH2OCH2CH3+H2O C 分液漏斗 蒸馏 80%
【解析】
从反应原理来看,溴化钠与浓硫酸反应生成HBr,乙醇与溴化氢发生取代反应生成溴乙烷。从题给的溴乙烷沸点数据可知要加入冰水进行溴乙烷的收集。溴乙烷中混有的杂质为溴单质,除杂试剂的选择,要考虑利用各物质的性质差异。
(1)已知:NaBr+H2SO4=HBr+NaHSO4,则烧瓶中的溴化氢和乙醇反应生成溴乙烷,化学方程式为:CH3CH2OH+HBr ![]() CH3CH2Br+H2O;
CH3CH2Br+H2O;
(2)已知溴乙烷的沸点38.4℃,加热时生成的溴乙烷被蒸馏出来,故U形管外冰水的作用是使其冷却,减少溴乙烷挥发;乙醇可以与水形成分子间氢键而溴乙烷不能,所以溴乙烷的水溶性小于乙醇的水溶性;溴乙烷为无色油状液体,则U型管内的现象是:有油状液体生成;
(3)温度过高会产生乙烯或者乙醚,化学方程式为:
CH3CH2OH ![]() CH2=CH2+H2O或2CH3CH2OH
CH2=CH2+H2O或2CH3CH2OH![]() CH3CH2OCH2CH3+H2O;
CH3CH2OCH2CH3+H2O;
(4) 溴乙烷溶解溴单质的能力强于水,不选择水,A项排除;
四氯化碳与溴和溴乙烷相互溶解,无法除去溴单质,B项排除;
亚硫酸钠与溴单质发生氧化还原反应,可除去溴单质,C项正确;
主要成分溴乙烷能和氢氧化钠水溶液能发生水解反应,D项排除;综上选择C项;
分液所需的主要玻璃仪器是分液漏斗;经氯化钙干燥后溴乙烷中含有一定量的乙醇、乙醚等有机物杂质,可以利用其沸点的差异,可采用蒸馏法分离;
(5)乙醇和溴化氢1:1反应。分别计算乙醇与溴化钠的物质的量:n(C2H5OH)=0.789 g/cm3×10 mL×0.95÷46g/mol=0.16mol,n(NaBr)=23g÷103g/mol=0.22mol,得乙醇的量小于溴化钠的量,所以计算产率选择乙醇的量进行计算。理论可生成溴乙烷的质量为:0.16mol×109g/mol=17.44g,实际生成溴乙烷质量为14.2g,所以产率为:14.2g÷17.44g≈80%。

【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。