题目内容
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
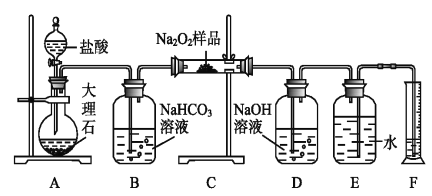
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
【答案】(1)CaCl2或BaCl2(合理答案均可)
(2)①CaCO3+2H+=Ca2++H2O+CO2↑②检查装置的气密性③否
④2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑
⑤吸收未反应的CO2⑥a⑦![]() (写出正确表达式未化简也给分)⑧偏小
(写出正确表达式未化简也给分)⑧偏小
【解析】
试题分析:(1)Na2O2易变质,与空气中CO2反应,生成Na2CO3,Na2CO3与BaCl2溶液或Ba(NO3)2溶液等易反应,生成白色BaCO3沉淀,而Na2O2与水反应所得溶液不能与BaCl2溶液或Ba(NO3)2溶液反应;
(2)①A中发生反应离子方程式为CaCO3+2H+ = Ca2++ H2O+CO2↑;
②根据题意,该实验成功的关键是准确测量反应生成氧气的体积,因此必须检查整套装置是否漏气;
③由于需要排水法测量体积,因此B装置出来的气体不需要干燥;
④生成的CO2中含有水蒸气,则装置C中发生的所有反应的化学方程式为2Na2O2+2CO2 = 2Na2CO3+O2、2Na2O2+2H2O = 4NaOH+O2↑。
⑤D中NaOH溶液的作用是吸收未反应的CO2。
⑥a、C中反应是放热反应,产生的氧气温度高于室温,故不冷却读数导致氧气体积偏大,a错误;
b.上下移动量筒,使得E、 F中液面高度相同,b正确;c.视线与凹液面的最低点相平读取量筒中水的体积,c正确,答案选a;
⑦由V/Vm可知n(O2)=![]() ,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2×
,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2×![]() ,由nM可知,m(O2)=2×
,由nM可知,m(O2)=2×![]() ×78gmol—1,则样品中Na2O2的质量分数=
×78gmol—1,则样品中Na2O2的质量分数=![]() ×100%=
×100%= ×100%=
×100%=![]() ×100%或
×100%或![]() ;
;
⑧该实验成功的关键是准确测量反应生成氧气的体积,E到F之间导管内水的体积没有办法测量会引起氧气体积减小,测定结果偏小。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案