题目内容
【题目】科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。

请回答下列问题:
(1)下列相关说法中,正确的是________(填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
(2)已知白磷、NH4+ 、N4H44+的空间构型均为四面体结构,参照NH4+和白磷的结构式,画出N4H44+的结构式(配位键用![]() 表示)________________;
表示)________________;
(3)在叶绿素结构示意图上标出N与Mg元素之间的配位键和共价键(配位键用![]() 表示)_______
表示)_______
(4)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3-的电子式_____________;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是 ________________,写一种与SO42-等电子体的分子 ________________。
(5)六方相氮化硼晶体内B-N键数与硼原子数之比为_______,其结构与石墨相似却不导电,原因是_______________________________________。

【答案】b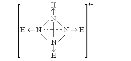
![]()
![]() +3N3-、NH3CCl4、SiCl4、CBr4、SiF4等合理答案即可3:1立方氮化硼晶体内无自由移动的电子
+3N3-、NH3CCl4、SiCl4、CBr4、SiF4等合理答案即可3:1立方氮化硼晶体内无自由移动的电子
【解析】
本题为新情景题,主要考查我们灵活运用所学基础知识,分析解答新问题的能力。
(1)由题意可知,N4与N2是由氮元素组成的两种不同的单质,二者互为同素异形体;一个N2中含有2个π键;结构相似的分子晶体,相对分子量越大,熔沸点越高;同主族从上到下,非金属性减弱,以此解答。
(2)因为N4H44+的空间构型与P4相同,即N4H44+中的四个氮原子构成正四面体结构,每个氮原子与另外三个氮原子以共价键结合,且四个氮原子分别单方面提供共用电子对与H+结合,用“→”表示。
(3)镁离子为+2价,和4个氮原子作用,形成2个共价键和两个配位键。
(4) N3-和CO2是等电子体,根据CO2的电子式写出N3-的电子式;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,配位体:提供孤电子对的分子或离子;等电子体是具有相同的价电子数和原子数的分子或离子。
(5) 六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,该物质的层状结构中不存在自由移动的电子,以此解答。
(1) a.分子式相同结构不同的化合物互称同分异构体,N4与N2都是N元素的单质,属于同素异形体,故a错误;
b.一个N2中含有2个π键,1mol N4分解生成2molN2,形成了4mol π键,故b正确;
c.结构相似的分子晶体,相对分子量越大,熔沸点越高,白磷的相对分子量比N4大,与键能无关,故c错误;
d.同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比N2活泼,与共价键稳定性有关,故d错误;
故答案为:b;
(2) N4H44+中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则N4H44+的结构图为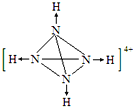 ;
;
故答案为: ;
;
(3)由叶绿素结构示意图可知,有两个氮原子提供孤对电子,镁元素提供空轨道,形成两个配位键,另外两个氮原子和镁原子形成共价键,故答案为:![]() ;
;
(4)N3-和CO2是等电子体,根据CO2的电子式写出N3-的电子式为![]() ;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,设钴的化合价为+x,则+x+(-1)+(-2)=0,解得x=+3价,它的配体是N3-、NH3;SO42-中含有32个价电子和5个原子,其等电子体的分子可以为CCl4、SiCl4、CBr4、SiF4等;
;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,设钴的化合价为+x,则+x+(-1)+(-2)=0,解得x=+3价,它的配体是N3-、NH3;SO42-中含有32个价电子和5个原子,其等电子体的分子可以为CCl4、SiCl4、CBr4、SiF4等;
故答案为:![]() ;+3;N3-、NH3;CCl4、SiCl4、CBr4、SiF4等;
;+3;N3-、NH3;CCl4、SiCl4、CBr4、SiF4等;
(5)六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,六方相氮化硼晶体内B-N键数与硼原子数之比为3:1,该物质的层状结构中不存在自由移动的电子,所以不导电,
故答案为:3:1;立方氮化硼晶体内无自由移动的电子。