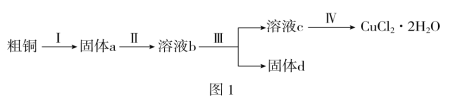
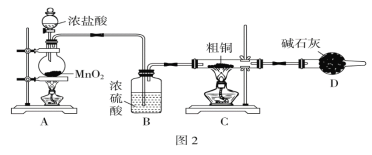
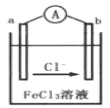
题目内容
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E与C同主族且处于C的下两个周期。试回答:
(1)A是________(写元素符号),D是________(写元素名称).
(2)B的离子结构示意图________,A的单质分子的电子式__________,C元素最高价氧化物对应的水化物的电子式________。
(3)用电子式表示H2A形成过程:____________________。
(4)写出CD的溶液中通入氯气的离子方程式:_______________
(5)比较B、C、E三种元素形成的简单离子的半径大小:(B、C、E离子用实际离子符号表示) ________ > __________ > __________ 。
(6) 比较C 、E 两元素最高价氧化物对应的水化物的碱性强弱(用化学式表示)________ > __________。
【答案】O 碘 
![]()
![]()
![]() Cl2+2I-===2Cl-+I2 Cs+ K+ Al3+ CsOH KOH
Cl2+2I-===2Cl-+I2 Cs+ K+ Al3+ CsOH KOH
【解析】
现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体,则A为氧元素;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;
⑥C为钾元素,E、C同主族,且E比C多两个电子层,则E为Cs元素.
(1)A是O(写元素符号),D是碘(写元素名称)。
(2)B为铝元素,离子结构示意图 ,A是O,单质分子的电子式
,A是O,单质分子的电子式![]() ,C为钾元素,最高价氧化物对应的水化物KOH的电子式
,C为钾元素,最高价氧化物对应的水化物KOH的电子式![]() 。
。
(3)氧最外层6个电子,与氢形成2对共用电子对,用电子式表示H2A形成过程:![]() 。
。
(4)氯气能将碘离子氧化,KI的溶液中通入氯气的离子方程式:Cl2+2I-===2Cl-+I2
(5)B是铝元素,C为钾元素,D是铯元素,位于不同周期,离子的电子层数越多,半径越大,则有Cs+>K+>Al3+。
(6) 金属性Cs>K,C、E 两元素最高价氧化物对应的水化物的碱性强弱(用化学式表示) CsOH > KOH。

 七星图书口算速算天天练系列答案
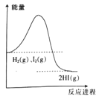
七星图书口算速算天天练系列答案【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是____。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是____mol/(Lmin);10秒末NH3的浓度是___mol/L;N2 的的物质的量___mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
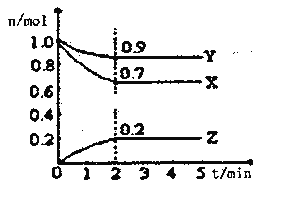
(1)该反应的化学方程式为___________
(2)从开始至2min,Z的平均反应速率为____________;
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量. E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂