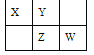题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],俗名莫尔盐,蓝绿色的固体,易溶于水,几乎不溶于乙醇,在 100℃~110℃时分解,对光敏感。在空气中逐渐风化及氧化。在空气中比硫酸亚铁稳定,有还原性。常用作重铬酸钾、高锰酸钾等溶液的互相标定的标准物质。一般用废铁屑经以下流程制取:

(1)检验莫尔盐固体中亚铁离子,可将样品溶于水后,滴加 K3[Fe(CN)6]溶液,反应的现象是________________。
(2)下列说法中正确的有____。
A.用 NaOH 溶液洗涤废铁屑的作用是去除废铁屑表面的油污和氧化铁杂质
B.蒸发应用小火小心加热,直到出现大量晶体停火利用余热蒸干溶剂
C.过滤后可用少量乙醇洗涤
D.检验莫尔盐固体样品中铵离子,可将样品溶于水后,再加足量 NaOH 稀溶液,将湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,表明固体中存在 NH4+,否则无 NH4+
E.检验莫尔盐固体是否氧化变质,可将样品溶于水后,滴加 KSCN 溶液,溶液变红,说明氧化变质
(3)用重铬酸钾溶液标定(滴定)莫尔盐溶液浓度,若需配制浓度为 0.01000molL-1 的 K2Cr2O7 标准溶液 250mL,应准确称取____________________g K2Cr2O7(保留 4 位有效数字,已知 M( K2Cr2O7)=294.0gmol-1).配制该标准溶液时,下列仪器中不必要用到的有__________________ .
①电子天平 ②烧杯 ③温度计 ④玻璃棒 ⑤容量瓶⑥铁架台(带铁圈) ⑦胶头滴管
滴定操作中,如果滴定前装有 K2Cr2O7 标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____(填“偏大”、“偏小”或“不变”)。
(4)向(NH4)2Fe(SO4)2 溶液中滴加一定量的 NaOH 溶液时,发生的总反应的离子方程式一定错误的是____。(填字母)
A.Fe2++2OH-===Fe(OH)2↓
B.NH4++OH-===NH3·H2O
C.Fe2++3OH-+NH4+===Fe(OH)2↓+NH3·H2O
D.Fe2++5OH-+3NH4+===Fe(OH)2↓+3NH3·H2O
【答案】出现蓝色沉淀 CE 0.7350g ③⑥ 偏大 BD
【解析】
(1) Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀。
(2) NaOH 溶液可以去除废铁屑表面的油污;硫酸亚铁铵在 100℃~110℃时分解,蒸发时应用小火小心加热,待晶膜出现,停火利用余热蒸发溶剂,过滤所得悬浊液;因为硫酸亚铁铵易溶于水,几乎不溶于乙醇,故过滤后用少量乙醇洗涤;检验铵离子,利用铵根离子可以和强碱反应生成氨气,但氨气极易溶于水,注意溶液反应的时候需要加热;铁离子(Fe3+)与SCN-反应生成显血红色络合物,是检验铁离子的常用方法。
(3)计算K2Cr2O7的质量可以用m=M×n进行计算;配置一定物质的量浓度的溶液需要用到的仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管;滴定溶液的影响因素根据c(待测)=![]() ,分析操作对待测液的物质的量浓度的影响。
,分析操作对待测液的物质的量浓度的影响。
(4)加入 NaOH 溶液时,Fe2+先反应,NH4+后反应。
(1)K3[Fe(CN)6]检验 Fe2+,会生成 Fe3[Fe(CN)6]2 特征蓝色沉淀
(2)用 NaOH 溶液洗涤废铁屑的作用是去除废铁屑表面的油污,但 NaOH 溶液并不能和铁的氧化物杂质反应;硫酸亚铁铵在 100℃~110℃时分解,故蒸发应用小火小心加热,蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂,得到的是浊液,分离操作是过滤,而不能蒸干后转移;又因硫酸亚铁铵易溶于水,几乎不溶于乙醇,故过滤后用少量乙醇洗涤;检验铵离子,可将样品溶于水后,再加足量 NaOH 溶液,并加热,将湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,表明固体中存在 NH4+;固体在空气中氧化变质会生成铁离子,检验铁离子可将样品溶于水后,滴加 KSCN 溶液,溶液变红,说明氧化变质。故选 CE。
(3)用重铬酸钾溶液标定莫尔盐溶液的反应为 6Fe(NH4)2(SO4)2+7H2SO4+K2Cr2O7= Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O+6(NH4)2SO4m(K2Cr2O7)=0.01000molL-1×0.250 L×294.0 gmol-1=0.7350g;根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,容量瓶用于配置溶液,胶头滴管用于加水定容.故用不到的仪器为温度计和铁架台;如果滴定前装有 K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,这样就造成读数偏小;滴定结束后气泡消失,这样读数就正常,所以读出来的 K2Cr2O7 标准溶液体积偏大,测定结果将偏大,故答案为:0.7350g;③⑦;偏大。
(4)由于加入 NaOH 溶液时,Fe2+先反应,NH4+后反应,所以若 NaOH 量不足,可能只有 Fe2+发生反应,所以 A 正确、B 错误;也可能 Fe2+ 完全反应而 NH4+部分或完全反应,即离子方程式中 n(NH4+):n(Fe2+)≤ 2:1,所以 C 正确 D 错误,故答案为:BD。

 名题金卷系列答案
名题金卷系列答案【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是____。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是____mol/(Lmin);10秒末NH3的浓度是___mol/L;N2 的的物质的量___mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
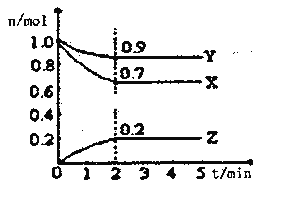
(1)该反应的化学方程式为___________
(2)从开始至2min,Z的平均反应速率为____________;
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量. E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂